Фангді


Інструкція із застосування Фангді
Перекладено з використанням ШІ
Інформація на цій сторінці має довідковий характер і не замінює консультацію лікаря. Перед застосуванням будь-яких лікарських засобів проконсультуйтеся з медичним фахівцем.
Показати оригіналЗміст інструкції
УПАКОВУВАНА ІНСТРУКЦІЯ: ІНФОРМАЦІЯ ДЛЯ
ПОТРІБНОГО
FANHDI
500 МО ФVIII + 600 МО VWF
Порошок і розчинник для приготування розчину для ін'єкцій і інфузій
Комплекс людського фактору згортання крові VIII і людського фон Віллебранда
Необхідно уважно ознайомитися з вмістом інструкції до застосування препарату, оскільки вона містить важливу інформацію для пацієнта.
- Необхідно зберегти цю інструкцію, щоб у разі потреби знову її прочитати.
- У разі виникнення будь-яких сумнівів необхідно звернутися до лікаря або фармацевта.
- Цей препарат призначений лише для певної особи. Не слід його передавати іншим. Препарат може нашкодити іншій особі, навіть якщо симптоми її хвороби такі самі.
- Якщо у пацієнта виникнуть будь-які непередбачені симптоми, включаючи всі непередбачені симптоми, не перелічені в цій інструкції, необхідно повідомити про це лікаря або фармацевта. Див. пункт 4.
Перелік вмісту інструкції:
- 1. Що таке препарат FANHDI і для чого він призначений
- 2. Інформація, яка повинна бути відомою до застосування препарату FANHDI
- 3. Як застосовувати препарат FANHDI
- 4. Можливі непередбачені дії
- 5. Як зберігати препарат FANHDI
- 6. Зміст упаковки і інші відомості
1. ШО ЦЕ Є ПРЕПАРАТ FANHDI І ДЛЯ ЧОГО ВІН ПРИЗНАЧЕНИЙ
FANHDI, випускається у вигляді порошку і розчинника для приготування розчину для ін'єкцій і інфузій у флаконах, які містять номінально 500 МО людського фактору згортання крові VIII (FVIII) і 600 МО людського фон Віллебранда (VWF).
Після розчинення у відповідній кількості розчинника (вода для ін'єкцій) продукт містить 50 МО/мл FVIII і 60 МО/мл VWF.
Фармакотерапевтична група: антигеморагічні препарати, комбінація фактору згортання крові VIII і фон Віллебранда.
FANHDI застосовується для профілактики і лікування кровотеч у хворих на гемофілію А (вроджений дефіцит фактору згортання крові VIII).
- 1.3.1. SPC, labelling and package leaflet
Застосування FANHDI також показане для профілактики і лікування кровотеч (у тому числі під час хірургічних операцій) у хворих на хворобу фон Віллебранда (VWD), коли лікування десмопресином (DDAVP) неефективне або протипоказане.
Продукт може бути застосований для лікування набутого дефіциту людського фактору згортання крові VIII.
2. ІНФОРМАЦІЯ, ЯКА ПОВИННА БУТИ ВІДОМОЮ ДО ЗАСТОСУВАННЯ ПРЕПАРАТУ FANHDI
Коли не застосовувати препарат FANHDI
- Якщо у пацієнта виникла чутливість (гіперчутливість) до комплексу фактору згортання крові VIII і фон Віллебранда або будь-якого іншого компонента цього препарату (перелічених у пункті 6).
Необхідно звернутися до лікаря, якщо потрібна порада або додаткова інформація.
Осторожності та заходи обережності
- У рідких випадках можуть виникнути анафілактичні реакції (нагальні сильні реакції). Чутливість до FANHDI може проявлятися висипкою, загальною кропив'янкою, відчуттям стискання в грудній клітці, головокружінням, а також при стоячому положенні. У разі виникнення цих симптомів необхідно припинити введення препарату і повідомити про це лікаря.
- Для визначення дози FANHDI, яка забезпечує досягнення і підтримання відповідного рівня фактору VIII, лікар може призначити виконання серії досліджень.
- Якщо кровотеча не припиняється, незважаючи на введення FANHDI, необхідно повідомити про це лікаря. Це може бути пов'язано з виробництвом інгібітора фактору VIII, що вимагає підтвердження у дослідженнях. Інгібітори фактору VIII - це антитіла, які блокують дію введеного фактору VIII. В результаті відбувається зниження ефективності фактору VIII у припиненні кровотеч.
- Якщо раніше вже відбулося утворення інгібітора фактору VIII, а потім лікування було змінено на інший продукт, що містить фактор VIII, існує більший ризик повторного виникнення цього ускладнення.
- Під час лікування хвороби фон Віллебранда з відомими клінічними або лабораторними факторами ризику існує загроза виникнення тромботичних ускладнень. З цієї причини необхідно провести відповідні дослідження для раннього виявлення симптомів, викликаних ними, та застосування актуальної рекомендації щодо лікування тромботичних ускладнень.
- У хвороби фон Віллебранда, зокрема типу 3, можуть утворюватися нейтралізуючі антитіла (інгібітори) фон Віллебранда. Інгібітори фон Віллебранда - це антитіла, які можуть блокувати введений фактор. У таких випадках, коли лікування не забезпечує очікуваних рівнів активності фон Віллебранда в плазмі або не вдається припинити кровотечу незважаючи на застосування відповідних доз, необхідно провести дослідження для виявлення наявності інгібітора фон Віллебранда. У пацієнтів з високим рівнем інгібітора лікування фон Віллебранда може бути неефективним.
- 1.3.1. SPC, labelling and package leaflet
Якщо для введення FANHDI необхідно застосувати центральний венозний доступ, лікар повинен бути готовий до можливості виникнення місцевої інфекції, бактеріємії (інфекції крові бактеріями) та утворення тромбу в венозному судині в місці введення катетера.
- Під час виробництва продуктів, отриманих з людської крові або плазми, застосовуються наступні заходи для забезпечення захисту від передачі інфекційних агентів:
- докладний відбір донорів для виключення носіїв інфекційних агентів,
- перевірка кожної донорської крові та плазми на наявність вірусів,
- застосування процедур інактивації/видалення вірусів з крові та плазми під час виробництва.
Незважаючи на це, не можна повністю виключити передачу інфекційних агентів під час застосування препаратів, отриманих з людської крові або плазми. Це стосується також невідомих або нових вірусів та інших патогенів.
Застосовані методи вважаються ефективними щодо вірусів з оболонкою, таких як вірус людського імунодефіциту (ВІЛ), гепатиту Б (HBV), гепатиту С (HCV) та безоболонкового вірусу гепатиту А. Ефективність цих методів щодо безоболонкових вірусів, таких як парвовірус Б19, може бути обмеженою.
Інфекція парвовірусом Б19 може бути особливо небезпечною для жінок під час вагітності (інфекція плоду) та для осіб з зниженою імунною системою або певними видами анемії (наприклад, серпоподібної анемії або гемолітичної анемії).
У пацієнтів, які регулярно приймають повторні дози препаратів, отриманих з плазми, що містять фактор VIII, лікар, який проводить лікування, може рекомендувати застосування відповідних вакцин проти вірусу гепатиту А і Б.
Рекомендується обов'язково реєструвати прізвище пацієнта та номер серії препарату при кожному введенні препарату FANHDI, щоб можна було зв'язати пацієнта з серією препарату.
Див. також пункт 4
Діти та підлітки
Перелічені попередження та заходи обережності стосуються як дорослих, так і дітей.
- 1.3.1. SPC, labelling and package leaflet
FANHDI та інші препарати
Необхідно повідомити лікаря про всі препарати, які приймає пацієнт зараз або останнім часом, а також про препарати, які пацієнт планує приймати.
Взаємодії комплексу людського фактору згортання крові VIII і фон Віллебранда з іншими препаратами не відомі.
Вагітність і годування грудьми
Через те, що гемофілія А рідко зустрічається у жінок, немає даних щодо застосування комплексу фактору FVIII/VWF під час вагітності та годування грудьми.
Необхідно звернутися до лікаря або фармацевта, перш ніж почати приймати будь-який препарат.
Проведення транспортних засобів і обслуговування машин
FANHDI не впливає на здатність керувати транспортними засобами та обслуговувати машини.
3. ЯК ЗАСТОСОВУВАТИ ПРЕПАРАТ FANHDI
Препарат повинен бути введений внутрішньовенно. Швидкість введення не повинна перевищувати 10 мл/хв.
Необхідно слідувати інструкціям лікаря або працівника служби охорони здоров'я з центру лікування гемофілії. У разі виникнення сумнівів необхідно звернутися до лікаря або фармацевта.
Розмір застосовуваної дози FANHDI залежить від багатьох факторів, таких як маса тіла, клінічний стан та тип і ступінь кровотечі. Для досягнення відповідного рівня фактору VIII і фон Віллебранда в крові лікар визначає розмір дози FANHDI та частоту її введення.
Лікар визначає тривалість лікування препаратом FANHDI.
Не зберігати залишки для подальшого застосування, навіть якщо вони будуть зберігатися в холодильнику.
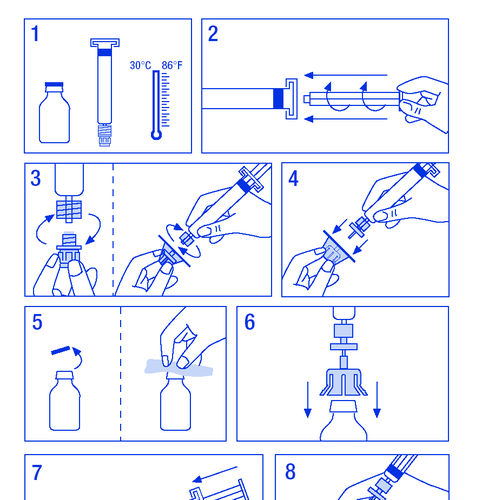
Підготовка розчину:
Необхідно переконатися, що дії будуть виконані в умовах, що запобігають забрудненню.
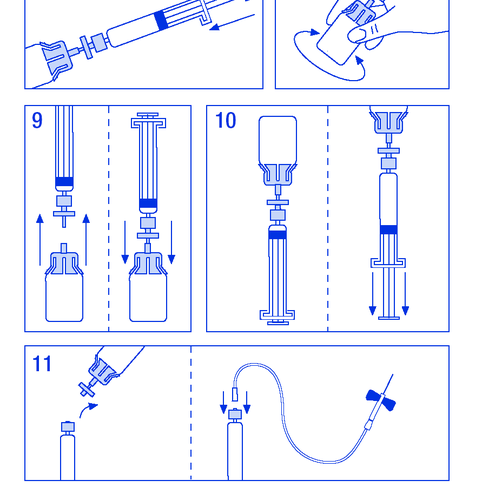
- 1. Розігріти флакони до температури не вище 30 °C (рисунок № 1).
- 2. Закріпити поршень у шприці з розчинником (рисунок № 2).
- 1.3.1. SPC, labelling and package leaflet
- 3. Вийняти фільтр з упаковки. Зняти пластикову кришку з кінця шприця та закріпити фільтр (рисунок № 3).
- 4. Вийняти з'єднувач до флакона та прикріпити шприць з фільтром (рисунок № 4).
- 5. Зняти пластикову кришку з флакона та відкрити гумову пробку, дезінфікувати засобом для дезінфекції (рисунок № 5).
- 6. Проколити пробку в флаконі голкою з'єднувача (рисунок № 6).
- 7. Ввести весь розчинник до флакона (рисунок № 7).
- 8. Нежно потрясти флакон, поки порошок не розчиниться (рисунок № 8). Як і у випадку з іншими препаратами для внутрішньовенного введення, не слід застосовувати, якщо препарат не розчинився або видимі частинки.
- 9. Від'єднати шприць з фільтром від флакона, щоб впустити повітря (рисунок № 9).
- 10. Перевернути флакон догори дном та аспірувати розчин до шприця (рисунок № 10).
- 11. Підготувати місце для ін'єкції, від'єднати шприць та ввести препарат через закріплену голку-бабочку або іншу стерильну голку. Вводити повільно внутрішньовенно зі швидкістю 3 мл/хв і ніколи не перевищувати 10 мл/хв, щоб уникнути реакцій на судини (рисунок № 11).
- 1.3.1. SPC, labelling and package leaflet
- 1.3.1. SPC, labelling and package leaflet
Не застосовувати знову набір для введення.
Всі залишки незастосованого препарату та інші відходи слід видалити згідно з місцевими правилами.
Застосування більшої, ніж рекомендована, дози FANHDI
Не було зареєстровано жодного випадку передозування комплексу людського фактору згортання крові VIII і фон Віллебранда. Після значного передозування можуть виникнути тромботичні ускладнення. Незалежно від цього, кожен випадок перевищення рекомендованої дози FANHDI необхідно негайно обговорити з фармацевтом або лікарем.
Пропуск застосування FANHDI
- Якщо доза була пропущена, необхідно негайно ввести наступну дозу та продовжити лікування регулярно згідно з рекомендаціями лікаря.
- Не слід застосовувати подвійну дозу для компенсації пропущеної дози.
4. МОЖЛИВІ НЕПЕРЕДБАЧЕНІ ДІЇ
Як і будь-який препарат, цей препарат може викликати непередбачені дії, хоча не в усіх вони виникають.
Гіперчутливість або алергічні реакції (анафілактичний шок, печія або відчуття колючого відчуття в місці ін'єкції, озноб, загальна кропив'янка, головний біль, висипка, зниження артеріального тиску, летаргія, нудота, тривога, тахікардія, відчуття стискання в грудній клітці, свербіж, блювота, свист) були спостережені рідко і лише в деяких випадках призводили до розвитку важкої анафілактичної реакції (включаючи встрясання).
У рідких випадках спостерігалося підвищення температури тіла.
У разі анафілактичної або алергічної реакції необхідно припинити введення препарату та негайно повідомити лікаря.
Не можна повністю виключити можливість виникнення алергічних реакцій після введення цього препарату.
Хворі на гемофілію А можуть утворювати нейтралізуючі антитіла (інгібітори) проти фактору VIII.
У разі виникнення таких інгібіторів спостерігається недостатня клінічна відповідь на лікування.
У дуже рідких випадках у пацієнтів з хворобою фон Віллебранда, зокрема типу 3, можуть утворюватися нейтралізуючі антитіла (інгібітори) фон Віллебранда. Якщо такі інгібітори виникнуть, спостерігається недостатня клінічна відповідь на лікування.
- 1.3.1. SPC, labelling and package leaflet
Інгібітори можуть впливати на зростання ризику виникнення алергічних реакцій (анафілактичного шоку). У разі виникнення алергічних реакцій необхідно провести дослідження на наявність інгібіторів.
У таких випадках рекомендується контактувати з спеціалізованим центром лікування порушень гемостазу.
Під час застосування препарату у пацієнтів з хворобою фон Віллебранда з відомими клінічними або лабораторними факторами ризику існує загроза виникнення тромботичних ускладнень.
Утримання надмірно високого рівня FVIII під час лікування препаратом, що містить фактор фон Віллебранда, збільшує ризик виникнення тромботичних ускладнень.
Під час кількох клінічних досліджень, проведених з участю 164 хворих, було введено в цілому 7000 інфузій FANHDI. Отримані результати з обох досліджень свідчать про добру толерантність препарату та низьку частоту виникнення непередбачених дій.
Було спостережено лише 2 випадки, у яких виникли дії, пов'язані з введенням препарату. У цих випадках було зареєстровано підвищення температури тіла.
Таблиця непередбачених дій
Нижче наведена таблиця категорій систем і органів (SOC та рівень терміна, який віддає перевагу) згідно з класифікацією MedDRA.
Частота виникнення оцінювалася згідно з наступними критеріями:
- дуже часто (≥ 1/10)
- часто (≥ 1/100 до <1>
- не дуже часто (≥ 1/1000 до <1>
- рідко (≥ 1/10 000 до <1>
- дуже рідко (<1>
- невідомо (частота не може бути визначена на підставі доступних даних).
У кожній категорії частоти непередбачені дії перелічені починаючи з найважчих до найлегших.
Діти та підлітки
Частота виникнення, тип та ступінь непередбачених дій, які очікуються у дітей, не відрізняються від тих, які спостерігаються у дорослих.
| Класифікація систем і органів | Непередбачені дії | Частота виникнення |
| Загальні порушення та стани в місці введення | Повышення температури тіла | Рідко |
- 1.3.1. SPC, labelling and package leaflet
Звіт про підозрювані непередбачені дії
Після реєстрації препарату важливо повідомляти про підозрювані непередбачені дії. Це дозволяє безперервно моніторити співвідношення користі та ризику застосування препарату.
Особи, які належать до медичного персоналу, повинні повідомляти про будь-які підозрювані непередбачені дії через:
Департамент моніторингу непередбачених дій лікарських засобів Міністерства охорони здоров'я
Ал. Єрозоліме 181С
02-222 Варшава
Тел.: +48 222 49 21 301
Факс: +48 222 49 21 309
e-mail: [email protected]
Звіт про непередбачені дії дозволяє зібрати більше інформації про безпеку застосування препарату.
Інформація щодо заходів захисту від передачі інфекційних агентів див. пункт 2.
- 2.
5. ЯК ЗБЕРІГАТИ ПРЕПАРАТ FANHDI
Препарат слід зберігати в місці, недоступному для дітей.
Не зберігати при температурі вище 30 °C. Не заморожувати.
Не слід застосовувати препарат після закінчення терміну придатності.
Розчин повинен бути прозорим і легенько опалесцентним.
Не слід застосовувати розчини, в яких спостерігаються осади або клякки.
Не слід застосовувати, якщо після розчинення в препараті спостерігаються частинки або розчин змінив колір.
Після відновлення хімічна та фізична стабільність препарату зберігається протягом 12 годин при температурі 25 °C. З мікробіологічної точки зору препарат повинен бути застосований негайно. Якщо після відновлення препарат не був застосований, його можна зберігати не довше 24 годин при температурі 2 °C - 8 °C, але тільки якщо відповідальність за це лежить на користувачеві та підготовка розчину відбулася згідно з правилами стерильності.
- 1.3.1. SPC, labelling and package leaflet
Препарати не слід викидати до каналізації. Необхідно запитати у фармацевта, як видалити препарати, які вже не використовуються. Таке поведінка допоможе захистити навколишнє середовище.
Строк придатності
3 роки,
Не слід застосовувати препарат після закінчення терміну придатності, вказаного на етикетці.
6. ЗМІСТ УПАКОВКИ ТА ІНШІ ВІДОМОСТІ
Що містить препарат FANHDI
Активна речовина - комплекс людського фактору згортання крові VIII і фон Віллебранда.
Кожна флакон з порошком містить 500 МО людського фактору згортання крові VIII і 600 МО фон Віллебранда.
Після розчинення у 10 мл води для ін'єкцій препарат містить 50 МО/мл FVIII і 60 МО/мл VWF.
Інші компоненти: людська альбумін, гістидин і аргінін.
Кожна шприць містить 10 мл води для ін'єкцій.
Як виглядає препарат FANHDI та що містить упаковка
Флакон з білим або світло-жовтим порошком та шприць з водою для ін'єкцій.
Кожна упаковка FANHDI містить флакон з 500 МО людського фактору згортання крові VIII і 600 МО фон Віллебранда (порошок для ін'єкцій і інфузій) та 1 шприць з 10 мл води для ін'єкцій (розчинник).
Набір для підготовки розчину та введення включений до упаковки FANHDI: з'єднувач до флакона, фільтр та набір для інфузії.
Доступні упаковки:
FANHDI 250 МО FVIII + 300 МО VWF
FANHDI 1000 МО FVIII + 1200 МО VWF
Не всі упаковки можуть бути в обігу.
Відповідальна особа та виробник
- 1.3.1. SPC, labelling and package leaflet
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Барселона, Іспанія
Для отримання більш детальної інформації необхідно звернутися до місцевого представника відповідальної особи:
Grifols Польща Сп. з о.о.
Вулиця Гжибо́вська, 87, 00-844 Варшава
Тел.: +48 22 378 85 61
Дата останньої актуалізації інструкції:
…………………………………………………………………………………………………
Інформація, призначена виключно для медичного персоналу:
Дозування
Дефіцит фактору згортання крові VIII
Дозування та тривалість заміщення залежать від ступеня дефіциту фактору VIII, місця та ступеня кровотечі, а також клінічного стану пацієнта.
Введену дозу фактору згортання крові VIII виражають у міжнародних одиницях (МО) згідно з чинними нормами ВООЗ для лікарських засобів, що містять людський фактор згортання крові VIII. Активність фактору згортання крові VIII в плазмі може бути виражена у процентах (відносно активності в нормальній плазмі) або в міжнародних одиницях (згідно з міжнародним стандартом для фактору згортання крові VIII в плазмі).
Одна міжнародна одиниця (МО) активності фактору згортання крові VIII відповідає кількості фактору згортання крові VIII у 1 мл нормальної людської плазми.
Лікування кровотеч
Обчислення необхідної дози фактору згортання крові VIII базується на емпіричному спостереженні, що введення 1 МО на кг маси тіла підвищує активність фактору згортання крові VIII в плазмі на 1,7% до 2,5% нормальної активності. Дозу обчислюють згідно з наступної формулою:
Потрібна кількість одиниць = маса тіла (кг) х потрібне підвищення активності фактору згортання крові VIII (%) (МО/дл) х 0,5
Розмір дози та частота введення повинні завжди коригуватися індивідуально для кожного випадку залежно від реакції пацієнта на лікування.
- 1.3.1. SPC, labelling and package leaflet
У лікуванні кровотеч, залежно від їхньої причини та місця, необхідно підтримувати протягом рекомендованого періоду лікування відповідний рівень активності фактору згортання крові VIII (у % від норми або МО/дл).
При встановленні дози залежно від типу кровотечі та хірургічної операції можна використовувати наступну таблицю:
| Ступінь кровотечі/тип хірургічної операції | Потрібний рівень фактору згортання крові VIII (%) (МО/дл) | Частота введення (години)/тривалість лікування (дні) |
| Кровотеча Свіжа кровотеча в суглоби, м'язи або кровотеча з порожнини рота. Більш важка кровотеча в суглоби, м'язи або гематома. Кровотеча, що загрожує життю. |
| Повторювати кожні 12-24 години протягом щонайменше 1 дня, поки не припиниться біль, викликаний кровотечею, або не заживе рана. Повторювати інфузії кожні 12-24 години протягом 3-4 днів або довше, поки не припиниться біль або не відновиться функція. Повторювати інфузії кожні 8-24 години, поки не припиниться загроза |
| Хірургічні операції Менші Включаючи видалення зуба Більші |
| Кожні 24 години, щонайменше протягом 1 дня, поки не заживе рана. Повторювати інфузії кожні 8-24 години, поки не досягне належного заживлення рани, потім продовжувати лікування протягом наступних 7 днів, підтримуючи активність фактору згортання крові VIII на рівні від 30% до 60% (МО/дл) |
Профілактичне лікування
У довгостроковій профілактиці кровотеч у пацієнтів з важкою формою гемофілії А зазвичай застосовують дозу від 20 до 40 МО на кг маси тіла з інтервалом 2-3 дні. У деяких випадках, особливо у молодих пацієнтів, може з'явитися необхідність скоротити інтервал між ін'єкціями або збільшити дозу.
- 1.3.1. SPC, labelling and package leaflet
Під час лікування для визначення дози та частоти введення інфузій рекомендується проводити відповідне визначення рівнів фактору VIII в плазмі. Особливо у випадках великих хірургічних операцій необхідно точне моніторинг заміщення лікування за допомогою досліджень системи згортання крові (активність фактору згортання крові VIII в плазмі).
Пацієнти можуть індивідуально реагувати на лікування фактором VIII, що відображається у різних рівнях відновлення in vivo та різних періодах напіврозпаду у окремих пацієнтів.
Хвороба фон Віллебранда
Загалом приймається, що введення 1 МО VWF:RCo на кг маси тіла підвищує рівень VWF:RCo на 2% у кровообігу. Метою лікування є досягнення рівня VWF:RCo > 0,6 МО/мл (60%) та FVIII:C > 0,4 МО/мл (40%) в плазмі.
У більшості випадків для досягнення гемостазу рекомендується доза 40-80 МО/кг маси тіла фон Віллебранда та 20-40 МО/кг маси тіла фактору FVIII:C.
Пацієнти з хворобою фон Віллебранда типу 3, у яких для підтримання відповідних рівнів фактору може з'явитися необхідність введення більших доз, можуть потребувати початкової дози фон Віллебранда 80 МО/кг маси тіла.
Вибрану дозу необхідно вводити кожні 12-24 години. Дозування та тривалість лікування залежать від клінічного стану пацієнта, місця та ступеня кровотечі, а також рівня як VWF:RCo, так і FVIII:C.
Під час застосування препаратів, що містять фактор VIII з фон Віллебрандом, лікар, який проводить лікування пацієнта, повинен враховувати можливість надмірного зростання рівня FVIII:C. Для уникнення надмірного зростання рівня FVIII:C після 24-48 годин лікування необхідно розглянути можливість зменшення дози або збільшення інтервалу між ін'єкціями або застосування препаратів, що містять VWF та меншу кількість фактору VIII.
- 24 – 48 годин лікування необхідно розглянути можливість зменшення дози або збільшення інтервалу між ін'єкціями або застосування препаратів, що містять VWF і менше фактору VIII.
Діти та підлітки
У вищезазначеному показанні доступні лише обмежені дані клінічних досліджень у дітей молодше 6 років, і тому немає рекомендацій щодо застосування препарату в цій віковій групі.
У дітей, у вищезазначених показаннях, коригування дози залежно від клінічної ефективності також полягає в розрахунку дози залежно від маси тіла.
- Країна реєстрації
- Діюча речовина
- Потрібен рецептТак
- Виробник
- ІмпортерInstituto Grifols, S.A.
- Ця інформація надана лише для ознайомлення і не є медичною порадою. Рішення щодо лікування завжди приймає лікар.
- Альтернативи до ФангдіЛікарська форма: Порошок, 25 МО/мл; 250 МО + 30 МО/мл; 300 МОДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: Instituto Grifols S.A.Потрібен рецептЛікарська форма: Порошок, 100 МО/мл; 1000 МО + 120 МО/мл; 1200 МОДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: Instituto Grifols S.A.Потрібен рецептЛікарська форма: Порошок, 1000 МО + 2400 МО/15 млДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: CSL Behring GmbHПотрібен рецепт
Аналоги Фангді в інших країнах
Препарати з тією самою діючою речовиною, доступні в інших країнах.
Аналог Фангді у Україна
Лікарі онлайн щодо Фангді
Застосування, безпека та можливість призначення рецепта — за результатами медичної оцінки.
Часті запитання

Будьте в курсі новин Oladoctor
Інформація про нові послуги, оновлення сервісу та корисні матеріали для пацієнтів.