Фангді


Інструкція із застосування Фангді
Перекладено з використанням ШІ
Інформація на цій сторінці має довідковий характер і не замінює консультацію лікаря. Перед застосуванням будь-яких лікарських засобів проконсультуйтеся з медичним фахівцем.
Показати оригіналЗміст інструкції
- Інструкція до застосування: Інформація для
- ПАЦІЕНТА
- FANHDI
- ШО ЦЕ Є ПРЕПАРАТ FANHDI І ДЛЯ ЧОГО ВІН ПРИЗНАЧЕНИЙ
- ІНФОРМАЦІЯ, ЯКА ПОВИННА БУТИ ВІДОМОЮ ПЕРЕД ЗАСТОСУВАННЯМ ПРЕПАРАТУ FANHDI
- ЯК ЗАСТОСОВУВАТИ ПРЕПАРАТ FANHDI
- МОЖЛИВІ НЕСПРИЯТЛІВІ ДІЇ
- ЯК ЗБЕРІГАТИ ПРЕПАРАТ FANHDI
- ЗМІСТ УПАКОВКИ ТА ІНШІ ВІДОМОСТІ
Інструкція до застосування: Інформація для
ПАЦІЕНТА
FANHDI
1000 МО ФVIII + 1200 МО VWF
Порошок і розчинник для приготування розчину для ін'єкцій та інфузій
Комплекс людського фактору згортання крові VIII і людського фон Віллебранда
Необхідно уважно ознайомитися з вмістом інструкції перед застосуванням препарату, оскільки вона містить важливу інформацію для пацієнта.
- Необхідно зберегти цю інструкцію, щоб у разі потреби мати можливість знову її прочитати.
- У разі будь-яких сумнівів необхідно звернутися до лікаря або фармацевта.
- Цей препарат призначений лише для конкретної особи. Необхідно уникати передачі його іншим. Препарат може нашкодити іншій особі, навіть якщо симптоми її хвороби такі самі.
- Якщо у пацієнта виникнуть будь-які несприятливі симптоми, включаючи всі несприятливі симптоми, не перелічені в цій інструкції, необхідно повідомити про це лікаря або фармацевта. Див. пункт 4.
Зміст інструкції:
- 1. Що таке препарат FANHDI і для чого він призначений
- 2. Інформація, яка повинна бути відомою перед застосуванням препарату FANHDI
- 3. Як застосовувати препарат FANHDI
- 4. Можливі несприятливі дії
- 5. Як зберігати препарат FANHDI
- 6. Зміст упаковки та інші відомості
1. ШО ЦЕ Є ПРЕПАРАТ FANHDI І ДЛЯ ЧОГО ВІН ПРИЗНАЧЕНИЙ
FANHDI, випускається у вигляді порошку і розчинника для приготування розчину для ін'єкцій та інфузій у флаконах, які містять номінально 1000 МО людського фактору згортання крові VIII (FVIII) і 1200 МО людського фон Віллебранда (VWF). Після розчинення у відповідній кількості розчинника (вода для ін'єкцій) продукт містить 100 МО/мл FVIII і 120 МО/мл VWF. Фармакотерапевтична група: препарати, що впливають на згортання крові, комбінація фактору згортання крові VIII і фон Віллебранда. FANHDI застосовується для профілактики та лікування кровотеч у хворих на гемофілію А (вроджений дефект фактору згортання крові VIII).
- 1.3.1. Характеристика, маркування та пакувальна література
Застосування FANHDI також показане для профілактики та лікування кровотеч (у тому числі кровотеч під час хірургічних операцій) у хворих на хворобу фон Віллебранда (VWD), коли лікування десмопресином (DDAVP) є неефективним або протипоказаним. Препарат може застосовуватися для лікування набутого дефекту людського фактору згортання крові VIII.
2. ІНФОРМАЦІЯ, ЯКА ПОВИННА БУТИ ВІДОМОЮ ПЕРЕД ЗАСТОСУВАННЯМ ПРЕПАРАТУ FANHDI
Коли не застосовувати препарат Fanhdi
- Якщо у пацієнта виникла чутливість (гіперчутливість) до комплексу фактору згортання крові VIII і фон Віллебранда або будь-якого іншого компонента цього препарату (перелічених у пункті 6).
Необхідно звернутися до лікаря, якщо потрібна порада або додаткова інформація.
Осторожності та заходи обережності
- У рідких випадках можуть виникнути анафілактичні реакції (нагальні сильні реакції). Чутливість до FANHDI може проявлятися висипкою, загальною кропив'янкою, відчуттям стискання в грудній клітці, головокружінням, а також при стоячому положенні. У разі виникнення цих симптомів необхідно припинити введення препарату і повідомити про це лікаря.
- Для визначення дози FANHDI, яка забезпечує досягнення та підтримання відповідного рівня фактору VIII, лікар може призначити проведення ряду досліджень.
- Якщо кровотеча не зупиняється, незважаючи на введення FANHDI, необхідно повідомити про це лікаря. Це може бути пов'язано з утворенням інгібітора фактору VIII, що вимагає підтвердження у дослідженнях. Інгібітори фактору VIII - це антитіла, які блокують дію введеного фактору VIII. В результаті цього знижується ефективність фактору VIII у припиненні кровотеч.
- Якщо раніше вже відбувалося утворення інгібітора фактору VIII, а потім лікування було змінено на інший препарат, що містить фактор VIII, існує більший ризик повторного виникнення цього ускладнення.
- Під час лікування хвороби фон Віллебранда з відомими клінічними або лабораторними факторами ризику виникнення загрози утворення тромбів. З цієї причини необхідно провести відповідні дослідження для раннього виявлення симптомів, викликаних цими факторами, та застосування актуально рекомендованого лікування ускладнень, пов'язаних з тромбами.
- У хвороби фон Віллебранда, особливо типу 3, можуть утворюватися нейтралізуючі антитіла (інгібітори) фон Віллебранда. Інгібітори фон Віллебранда - це антитіла, які можуть блокувати введений фактор. У тих випадках, коли лікування не забезпечує досягнення очікуваних рівнів активності фон Віллебранда в плазмі або не вдається зупинити кровотечу незважаючи на застосування відповідних доз, необхідно провести дослідження для виявлення наявності інгібітора фон Віллебранда. У пацієнтів з високим рівнем інгібітора лікування фон Віллебрандом може бути неефективним.
- 1.3.1. Характеристика, маркування та пакувальна література
Якщо для введення FANHDI необхідно застосувати центральний венозний доступ, лікар повинен бути готовий до можливості виникнення місцевої інфекції, бактеріємії (інфекції крові бактеріями) та утворення тромбу в венозному судині в місці введення катетера.
- Під час виробництва продуктів, отриманих з людської крові або плазми, застосовуються наступні заходи для забезпечення безпеки перед передачею інфекційних агентів:
- докладний відбір донорів для виключення носіїв інфекційних агентів,
- дослідження кожної донорської крові та плазми на наявність вірусів,
- застосування процедур інактивації/видалення вірусів з крові та плазми під час виробництва.
Незважаючи на це, не можна повністю виключити передачу інфекційних агентів під час застосування препаратів, отриманих з людської крові або плазми. Це стосується також невідомих або нових вірусів та інших патогенів. Застосовані методи вважаються ефективними щодо вірусів з оболонкою, таких як вірус імунодефіциту людини (ВІЛ), гепатиту В (HBV), гепатиту С (HCV) та безоболонкового вірусу гепатиту А. Ефективність цих методів щодо безоболонкових вірусів, таких як парвовірус В19, може бути обмеженою. Інфекція парвовірусом В19 може бути особливо небезпечною для жінок під час вагітності (інфекція плоду) та для осіб з зниженою імунною системою або певними формами анемії (наприклад, серпоподібної анемії або гемолітичної анемії). У пацієнтів, які регулярно приймають повторні дози препаратів, отриманих з плазми, що містять фактор VIII, лікар, який спостерігає за пацієнтом, може рекомендувати застосування відповідних вакцин (проти вірусу гепатиту А і В. Безумовно рекомендується, щоб при кожному введенні препарату FANHDI пацієнту реєстрували прізвище пацієнта та номер серії препарату, щоб можна було зв'язати пацієнта з серією препарату. Див. також пункт 4.
Діти та підлітки
Перелічені попередження та заходи обережності стосуються як дорослих, так і дітей.
- 1.3.1. Характеристика, маркування та пакувальна література
FANHDI та інші препарати
Необхідно повідомити лікаря про всі препарати, які приймає пацієнт зараз або приймав раніше, а також про препарати, які пацієнт планує приймати. Взаємодії комплексу людського фактору згортання крові VIII і фон Віллебранда з іншими препаратами невідомі.
Вагітність та годування грудьми
Через те, що гемофілія А рідко зустрічається у жінок, немає даних щодо застосування комплексу фактору FVIII/VWF під час вагітності та годування грудьми. Необхідно звернутися до лікаря або фармацевта, перш ніж почати приймати будь-який препарат.
Проведення транспортних засобів та обслуговування машин
FANHDI не впливає на здатність керувати транспортними засобами та обслуговувати машини.
3. ЯК ЗАСТОСОВУВАТИ ПРЕПАРАТ FANHDI
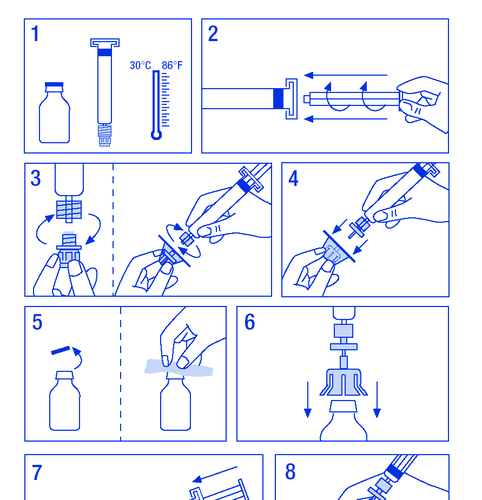
Препарат повинен вводитися внутрішньовенно. Швидкість введення не повинна перевищувати 10 мл/хв. Необхідно слідувати інструкціям лікаря або медичного працівника з центру лікування гемофілії. У разі виникнення сумнівів необхідно звернутися до лікаря або фармацевта. Розмір застосовуваної дози FANHDI залежить від багатьох факторів, таких як маса тіла, клінічний стан та тип і ступінь кровотечі. Для досягнення відповідного рівня фактору VIII і фон Віллебранда в крові лікар визначає розмір дози FANHDI та частоту її введення. Лікар визначає тривалість лікування препаратом FANHDI. Не зберігати залишки для подальшого застосування, навіть якщо вони будуть зберігатися в холодильнику. Приготування розчину: Необхідно переконатися, що дії будуть виконані в умовах, що запобігають забрудненню.
- 1. Огріти флакони до температури не вище 30 °C (рисунок № 1).
- 2. Закріпити поршень у шприці з розчинником (рисунок № 2).
- 3. Вийняти фільтр з упаковки. Зняти пластикову кришку з кінця шприця та закріпити фільтр (рисунок № 3).
- 1.3.1. Характеристика, маркування та пакувальна література
- 4. Вийняти з'єднувач до флакона та прикріпити шприць з фільтром (рисунок № 4).
- 5. Зняти пластикову кришку з флакона та відкрити гумовий корк, продезінфікувати засобом для дезінфекції (рисунок № 5).
- 6. Проколити корк у флаконі голкою з'єднувача (рисунок № 6).
- 7. Ввести весь розчинник до флакона (рисунок № 7).
- 8. Нежно потрясти флакон до розчинення порошку (рисунок № 8). Як і у випадку з іншими препаратами для внутрішньовенного введення, не застосовувати, якщо препарат не розчинений або видимі частинки.
- 9. Від'єднати шприць з фільтром від флакона, щоб впустити повітря (рисунок № 9).
- 10. Перевернути флакон догори дном та аспірувати розчин до шприця (рисунок № 10).
- 11. Підготувати місце для ін'єкції, від'єднати шприць та ввести препарат через зафіксовану голку-бабочку або іншу стерильну голку. Вводити повільно внутрішньовенно зі швидкістю 3 мл/хв і ніколи не перевищувати 10 мл/хв, щоб уникнути реакцій, пов'язаних з судинами (рисунок № 11).
- 1.3.1. Характеристика, маркування та пакувальна література
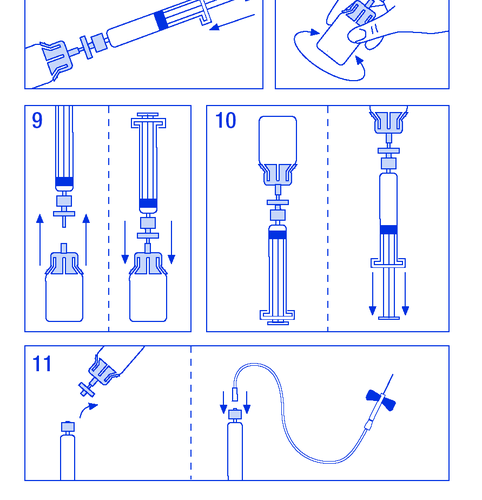
- 1.3.1. Характеристика, маркування та пакувальна література
Не застосовувати знову набір для введення. Всі залишки незастосованого препарату та інші відходи необхідно видалити згідно з місцевими правилами. Препарати не слід викидати у каналізацію. Необхідно запитати у фармацевта, як видалити препарати, які вже не використовуються. Таке поводження допоможе захистити навколишнє середовище.
Передозування
Не було зареєстровано жодного випадку передозування комплексу людського фактору згортання крові VIII і фон Віллебранда. Після значного передозування можуть виникнути ускладнення, пов'язані з тромбами. Незалежно від цього, кожен випадок перевищення рекомендованої дози FANHDI необхідно негайно обговорити з фармацевтом або лікарем.
Пропуск застосування
- Якщо доза була пропущена, необхідно негайно введення наступної дози та продовжити лікування регулярно згідно з рекомендаціями лікаря.
- Не слід застосовувати подвійну дозу для компенсації пропущеної дози.
4. МОЖЛИВІ НЕСПРИЯТЛІВІ ДІЇ
Як і будь-який препарат, цей препарат може викликати несприятливі дії, хоча не у всіх вони виникають. Гіперчутливість або анафілактичні реакції (обличчя, що стуляться, відчуття стискання в грудній клітці, головокружіння, загальна кропив'янка, біль у голові, висипка, зниження артеріального тиску, сонливість, нудота, тривога, тахікардія, відчуття стискання в грудній клітці, свист) спостерігалися рідко та лише в деяких випадках призводили до розвитку важкої анафілаксії (включаючи втримання дихання). У рідких випадках спостерігався підвищення температури тіла. У разі анафілактичної або алергічної реакції необхідно припинити введення препарату та негайно повідомити лікаря. Не можна повністю виключити можливість виникнення алергічних реакцій після введення цього препарату. Хворі на гемофілію А можуть утворювати нейтралізуючі антитіла (інгібітори) проти фактору VIII. У разі виникнення таких інгібіторів спостерігається недостатня клінічна відповідь на лікування. У дуже рідких випадках у пацієнтів з хворобою фон Віллебранда, особливо типу 3, можуть утворюватися нейтралізуючі антитіла (інгібітори) фон Віллебранда. Якщо такі інгібітори виникають, спостерігається недостатня клінічна відповідь на лікування. Інгібітори можуть впливати на зростання ризику виникнення алергічних реакцій (анафілаксії). У разі виникнення алергічних реакцій необхідно провести дослідження на наявність інгібіторів. У таких випадках рекомендується контактувати з спеціалізованим центром лікування порушень гемостазу. Під час застосування препарату у пацієнтів з хворобою фон Віллебранда з відомими клінічними або лабораторними факторами ризику виникнення загрози утворення тромбів існує небезпека виникнення ускладнень, пов'язаних з тромбами. Утримання надмірно високого рівня FVIII під час лікування препаратом, що містить фактор фон Віллебранда, збільшує ризик виникнення ускладнень, пов'язаних з тромбами. Під час кількох клінічних досліджень, проведених з участю 164 хворих, було введено в цілому 7000 інфузій FANHDI. Отримані результати з обох досліджень свідчать про хорошу толерантність препарату та низьку частоту виникнення несприятливих дій. Спостерігалися лише 2 випадки, у яких виникли несприятливі дії, пов'язані з введенням препарату. У цих випадках було зареєстровано підвищення температури тіла. Табличний перелік несприятливих дій Нижче наведена таблиця містить категорії систем та органів (SOC та Preferred Term Level) згідно з класифікацією MedDRA. Частота виникнення оцінювалася згідно з наступними критеріями:
- дуже часто (≥ 1/10)
- часто (≥ 1/100 до <1>
- не дуже часто (≥ 1/1000 до <1>
- рідко (≥ 1/10 000 до <1>
- дуже рідко (<1>
- невідома (частота не може бути визначена на основі наявних даних).
У кожній категорії частоти несприятливі дії перелічені починаючи з найважчих до найлегших.
| Класифікація систем та органів | Несприятливі дії | Частота виникнення |
| Загальні порушення та стани в місці введення | Підвищення температури тіла | Рідко |
- 1.3.1. Характеристика, маркування та пакувальна література
Діти та підлітки
Частота виникнення, тип та ступінь несприятливих дій, які очікуються у дітей, не відрізняються від тих, які спостерігаються у дорослих.
Зголошення підозрюваних несприятливих дій
Після реєстрації препарату важливо zgолошувати підозрювані несприятливі дії. Це дозволяє безперервно моніторити співвідношення користі та ризику застосування препарату. Особи, які належать до медичного персоналу, повинні zgолошувати всі підозрювані несприятливі дії через:
Відділ моніторингу несприятливих дій Державного реєстру лікарських засобів, медичних виробів та біоцидів вул. Алєє Єрозолімські, 181С 02-222 Варшава Телефон: +48 222 49 21 301 Факс: +48 222 49 21 309 електронна пошта: [email protected] Дякуючи zgолошенню несприятливих дій, можна зібрати більше інформації про безпеку застосування препарату. Інформація щодо заходів безпеки перед передачею інфекційних агентів див. пункт 2.
5. ЯК ЗБЕРІГАТИ ПРЕПАРАТ FANHDI
Препарат слід зберігати в місці, недоступному для дітей. Не зберігати при температурі вище 30 °C. Не заморожувати. Не слід застосовувати препарат після закінчення терміну придатності. Розчин повинен бути прозорим та легенько опалесцентним. Не застосовувати розчини, у яких спостерігаються осади або краплі. Не застосовувати, якщо після розчинення препарат містить частинки або розчин змінив колір. Після відновлення хімічна та фізична стабільність препарату зберігається протягом 12 годин при температурі 25 °C. З мікробіологічної точки зору препарат повинен бути застосований негайно. Якщо після відновлення препарат не був застосований, його можна зберігати не довше 24 годин при температурі 2 °C – 8 °C, але тільки у тому випадку, якщо відповідальність за це лежить на користувачі та якщо приготування розчину відбулося згідно з правилами стерильності. Препарати не слід викидати у каналізацію. Необхідно запитати у фармацевта, як видалити препарати, які вже не використовуються. Таке поводження допоможе захистити навколишнє середовище.
Строк придатності
3 роки. Не слід застосовувати препарат після закінчення терміну придатності, вказаного на етикетці.
6. ЗМІСТ УПАКОВКИ ТА ІНШІ ВІДОМОСТІ
Що містить препарат FANHDI
Активна речовина - комплекс людського фактору згортання крові VIII і фон Віллебранда. Кожна флакон з порошком містить 1000 МО людського фактору згортання крові VIII і 1200 МО фон Віллебранда. Після розчинення у 10 мл води для ін'єкцій препарат містить 100 МО/мл FVIII та 120 МО/мл VWF. Інші компоненти - людська альбумін, гістидин та аргінін. Кожна шприць містить 10 мл води для ін'єкцій. Кожна упаковка FANHDI містить флакон з 1000 МО людського фактору згортання крові VIII та 1200 МО фон Віллебранда (порошок для ін'єкцій та інфузій) та 1 шприць з 10 мл води для ін'єкцій (розчинник). Засоб для приготування розчину та введення включений до складу упаковки FANHDI: з'єднувач до флакона, фільтр та набір для інфузії. Доступні упаковки: FANHDI 250 МО FVIII + 300 МО VWF FANHDI 500 МО FVIII + 1200 МО VWF Не всі упаковки можуть бути в обігу.
Відповідальний суб'єкт та виробник
Instituto Grifols, S.A. Can Guasc, 2 - Parets del Vallès 08150 Барселона, Іспанія Для отримання більш детальної інформації необхідно звернутися до місцевого представника відповідального суб'єкта: Grifols Polska Sp. z o. o. вул. Гжибо́вська, 87 00-844 Варшава Телефон: +48 22 378 85 61
Дата останньої актуалізації інструкції:
………………………………………………………………………………………………… Інформація, призначена лише для медичного персоналу:
Дозування
Дефект фактору згортання крові VIII Дозування та тривалість заміщення залежать від ступеня дефекту фактору VIII, місця та ступеня кровотечі, а також клінічного стану пацієнта. Вводену дозу фактору згортання крові VIII виражають у міжнародних одиницях (МО) згідно з чинними нормами ВООЗ для лікарських засобів, що містять людський фактор згортання крові VIII. Активність фактору згортання крові VIII в плазмі може бути виражена у процентах (відносно активності у нормальній плазмі) або у міжнародних одиницях (згідно з міжнародним стандартом для фактору згортання крові VIII у плазмі). Одна міжнародна одиниця (МО) активності фактору згортання крові VIII відповідає кількості фактору згортання крові VIII у 1 мл нормальної людської плазми. Лікування кровотеч Обчислення необхідної дози фактору згортання крові VIII базується на емпіричному спостереженні, що введення 1 МО на кг маси тіла підвищує активність фактору згортання крові VIII у плазмі на 1,7% до 2,5% нормальної активності. Дозу обчислюють згідно з наступної формулою:
Необхідна кількість одиниць = маса тіла (кг) х необхідне підвищення активності фактору згортання крові VIII (%) (МО/дл) х 0,5
- 1.3.1. Характеристика, маркування та пакувальна література
Розмір доз та частота введення повинні завжди коригуватися індивідуально для кожного випадку залежно від реакції пацієнта на лікування. У лікуванні кровотеч, залежно від їхньої причини та місця, необхідно підтримувати протягом рекомендованого періоду лікування відповідний рівень активності фактору згортання крові VIII (у % від норми або МО/дл). При встановленні дози залежно від типу кровотечі та хірургічної операції можна використовувати наступну таблицю:
| Ступінь кровотечі/тип хірургічної операції | Необхідний рівень фактору згортання крові VIII (%) (МО/дл) | Частота введення (год)/тривалість лікування (дні) |
| Кровотеча Свежа кровотеча в суглоби, м'язи або кровотеча з порожнини рота. Більш важка кровотеча в суглоби, м'язи або гематома. Кровотеча, що загрожує життю. |
| Повторювати кожні 12-24 години не менше 1 дня, поки не зупиниться кровотеча або не заживе рана. Повторювати інфузії кожні 12-24 години протягом 3-4 днів або довше, поки не зупиниться кровотеча або не відновиться функція. Повторювати інфузії кожні 8-24 години, поки не зупиниться загроза. |
| Хірургічні операції Менші Включаючи видалення зуба Більш важкі |
| Кожні 24 години не менше 1 дня, поки не заживе рана. Повторювати інфузії кожні 8-24 години, поки не досягне належного заживлення рани, потім продовжувати лікування протягом наступних 7 днів, підтримуючи активність фактору згортання крові VIII на рівні від 30% до 60% (МО/дл) |
Профілактичне лікування У довгостроковій профілактиці кровотеч у пацієнтів з важкою формою гемофілії А зазвичай застосовують дозу від 20 до 40 МО на кг маси тіла з інтервалом 2-3 дні. У деяких випадках, особливо у молодих пацієнтів, може з'явитися необхідність скоротити інтервал між ін'єкціями або збільшити дозу. Під час лікування для визначення дози та частоти введення інфузій рекомендується проводити відповідне визначення рівнів фактору VIII у плазмі. Особливо у випадках важких хірургічних операцій необхідно проводити точний моніторинг заміщення за допомогою досліджень системи згортання крові (активність фактору VIII у плазмі). Пацієнти можуть індивідуально реагувати на лікування фактором VIII, що відображається у різних рівнях відновлення in vivo та різних періодах напіввиведення у окремих пацієнтів. Хвороба фон Віллебранда Загалом приймається, що введення 1 МО VWF:RCo на кг маси тіла підвищує рівень VWF:RCo на 2% у кровообігу. Метою лікування є досягнення рівня VWF:RCo > 0,6 МО/мл (60%) та FVIII:C > 0,4 МО/мл (40%) у плазмі. У більшості випадків для досягнення гемостазу рекомендується доза 40 – 80 МО/кг маси тіла фон Віллебранда та 20 – 40 МО/кг маси тіла фактору FVIII:C. Пацієнти з хворобою фон Віллебранда типу 3, у яких для підтримання відповідних рівнів фактору може з'явитися необхідність введення більших доз, можуть потребувати початкової дози фон Віллебранда 80 МО/кг маси тіла. Добру дозу необхідно вводити кожні 12 – 24 години. Дозування та тривалість лікування залежать від клінічного стану пацієнта, місця та ступеня кровотечі, а також рівня як VWF:RCo, так і FVIII:C. Під час застосування препаратів, що містять фактор VIII з фон Віллебрандом, лікар, який спостерігає за пацієнтом, повинен враховувати можливість надмірного зростання рівня FVIII:C. Для уникнення надмірного зростання рівня FVIII:C після 24 – 48 годин лікування необхідно розглянути можливість зменшення дози або збільшення інтервалу між введеннями чи застосування препаратів, що містять VWF та меншу кількість фактору VIII. Діти та підлітки У вищезазначеному показанні доступні лише обмежені дані клінічних досліджень у дітей молодше 6 років, і тому немає рекомендацій щодо застосування препарату в цій віковій групі. У дітей при вищезазначеному показанні коригування дози з метою досягнення клінічної ефективності полягає також у розрахунку дози залежно від маси тіла.
- Країна реєстрації
- Діюча речовина
- Потрібен рецептТак
- Виробник
- ІмпортерInstituto Grifols, S.A.
- Ця інформація надана лише для ознайомлення і не є медичною порадою. Рішення щодо лікування завжди приймає лікар.
- Альтернативи до ФангдіЛікарська форма: Порошок, 50 МО/мл; 500 МО + 60 МО/мл; 600 МОДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: Instituto Grifols S.A.Потрібен рецептЛікарська форма: Порошок, 25 МО/мл; 250 МО + 30 МО/мл; 300 МОДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: Instituto Grifols S.A.Потрібен рецептЛікарська форма: Порошок, 1000 МО + 2400 МО/15 млДіюча речовина: von Willebrand factor and coagulation factor VIII in combinationВиробник: CSL Behring GmbHПотрібен рецепт
Аналоги Фангді в інших країнах
Препарати з тією самою діючою речовиною, доступні в інших країнах.
Аналог Фангді у Україна
Лікарі онлайн щодо Фангді
Застосування, безпека та можливість призначення рецепта — за результатами медичної оцінки.
Часті запитання

Будьте в курсі новин Oladoctor
Інформація про нові послуги, оновлення сервісу та корисні матеріали для пацієнтів.