Фангди


Инструкция по применению Фангди
Перевод выполнен с помощью ИИ
Информация представлена в справочных целях и не заменяет консультацию врача. Перед приемом любых лекарств рекомендуется проконсультироваться с врачом. Oladoctor не несет ответственности за решения, принятые на основе этого материала.
Показать оригиналСодержание инструкции
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ДЛЯ ПАЦИЕНТА
ФАНХДИ
500 МЕ ФВIII + 600 МЕ ФВФ
Порошок и растворитель для приготовления раствора для инъекций и инфузий
Комплекс человеческого фактора свёртывания крови VIII и человеческого фактора Виллебранда
Необходимо тщательно ознакомиться с содержанием инструкции перед применением препарата, поскольку она содержит важную информацию для пациента.
- Необходимо сохранить эту инструкцию, чтобы в случае необходимости можно было её повторно прочитать.
- В случае любых сомнений необходимо обратиться к врачу или фармацевту.
- Этот препарат предназначен для применения у конкретного пациента. Не следует передавать его другим. Препарат может нанести вред другому человеку, даже если симптомы его заболевания такие же.
- Если у пациента出现ят любые нежелательные реакции, включая все нежелательные реакции, не перечисленные в этой инструкции, необходимо сообщить об этом врачу или фармацевту. См. пункт 4.
Содержание инструкции:
- 1. Что такое препарат ФАНХДИ и для чего он используется
- 2. Важная информация перед применением препарата ФАНХДИ
- 3. Как применять препарат ФАНХДИ
- 4. Возможные нежелательные реакции
- 5. Как хранить препарат ФАНХДИ
- 6. Состав упаковки и другие сведения
1. ЧТО ТАКОЕ ПРЕПАРАТ ФАНХДИ И ДЛЯ ЧЕГО ОН ИСПОЛЬЗУЕТСЯ
ФАНХДИ выпускается в виде порошка и растворителя для приготовления раствора для инъекций и инфузий в флаконах, содержащих номинально 500 МЕ человеческого фактора свёртывания крови VIII (ФВIII) и 600 МЕ человеческого фактора Виллебранда (ФВФ). После растворения в соответствующем количестве растворителя (воде для инъекций) продукт содержит 50 МЕ/мл ФВIII и 60 МЕ/мл ФВФ. Фармакотерапевтическая группа: антигеморрагические препараты, комбинация фактора свёртывания крови VIII и фактора Виллебранда. ФАНХДИ используется для профилактики и лечения кровотечений у пациентов с гемофилией А (врождённым дефицитом фактора свёртывания крови VIII).
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Применение ФАНХДИ также показано для профилактики и лечения кровотечений (в том числе во время хирургических операций) у пациентов с болезнью Виллебранда (БВ), когда лечение десмопрессином (ДДАВП) неэффективно или противопоказано. Продукт может быть использован для лечения приобретённого дефицита человеческого фактора свёртывания крови VIII.
2. ВАЖНАЯ ИНФОРМАЦИЯ ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТА ФАНХДИ
Когда не применять препарат ФАНХДИ
- Когда у пациента наблюдается аллергия (чувствительность) к комплексу фактора свёртывания крови VIII и фактора Виллебранда или к любому из других компонентов этого препарата (перечисленных в пункте 6).
Необходимо обратиться к врачу, если требуется совет или дополнительная информация.
Предостережения и меры предосторожности
- В редких случаях могут возникать анафилактические реакции (внезапные сильные аллергические реакции). Аллергия к ФАНХДИ может проявляться в виде сыпи, общей крапивницы, чувства сдавления в груди, головокружения, также при стоянии. В случае возникновения этих симптомов необходимо прекратить введение препарата и сообщить об этом врачу.
- Для определения дозы ФАНХДИ, обеспечивающей достижение и поддержание соответствующего уровня фактора VIII, врач может назначить проведение серии исследований.
- Если кровотечение не останавливается, несмотря на введение ФАНХДИ, необходимо сообщить об этом врачу. Это может быть вызвано образованием ингибитора фактора VIII, что требует подтверждения в исследованиях. Ингибиторы фактора VIII представляют собой антитела, которые блокируют действие введённого фактора VIII. В результате снижается эффективность фактора VIII в предотвращении кровотечений.
- Если ранее уже было образование ингибитора фактора VIII, а затем лечение было изменено на другой препарат, содержащий фактор VIII, то существует более высокий риск повторения этого осложнения.
- Во время лечения болезни Виллебранда с известными клиническими или лабораторными факторами риска существует опасность развития тромботических осложнений. Поэтому необходимо проведение соответствующих исследований для раннего обнаружения симптомов, вызванных этими осложнениями, и применение рекомендованного лечения тромботических осложнений.
- При болезни Виллебранда, в частности типа 3, могут образовываться нейтрализующие антитела (ингибиторы) фактора Виллебранда. Ингибиторы фактора Виллебранда представляют собой находящиеся в крови антитела, которые могут блокировать введённый фактор. В этих случаях, когда в лечении не достигается ожидаемого уровня активности фактора Виллебранда в сыворотке или не удаётся остановить кровотечение, несмотря на применение соответствующих доз, необходимо провести исследования для обнаружения наличия ингибитора фактора Виллебранда. У пациентов с высоким уровнем ингибитора лечение фактором Виллебранда может быть неэффективным.
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Ингибиторы могут влиять на увеличение риска возникновения аллергических реакций (анафилактического шока). В случае возникновения аллергических реакций необходимо провести исследования на наличие ингибиторов. В таких случаях рекомендуется обратиться в специализированный центр лечения нарушений гемостаза. Во время применения препарата у пациентов с болезнью Виллебранда с известными клиническими или лабораторными факторами риска существует опасность развития тромботических осложнений. Поддержание высокого уровня ФВIII во время лечения фактором VIII, содержащим фактор Виллебранда, увеличивает риск развития тромботических осложнений. Во время нескольких клинических исследований, проведённых с участием 164 пациентов, было введено в общей сложности 7000 инфузий ФАНХДИ. Полученные результаты из обоих исследований указывают на хорошую переносимость препарата и низкую частоту возникновения нежелательных реакций. Были зарегистрированы только 2 случая, в которых возникли нежелательные реакции, связанные с введением препарата. В этих случаях было зарегистрировано повышение температуры тела.
Таблица нежелательных реакций
Ниже представлена таблица категорий систем и органов (SOC и Preferred Term Level) в соответствии с классификацией MedDRA. Частота возникновения оценивалась по следующим критериям:
- очень часто (≥ 1/10)
- часто (≥ 1/100 до <1>
- не очень часто (≥ 1/1000 до <1>
- редко (≥ 1/10 000 до <1>
- очень редко (<1>
- неизвестна (частота не может быть определена на основе доступных данных).
В каждой категории частоты нежелательные реакции перечислены, начиная с наиболее тяжёлых до наиболее лёгких.
Дети и подростки
Частота возникновения, тип и тяжесть нежелательных реакций, ожидаемых у детей, не отличаются от тех, которые возникают у взрослых.
| Классификация систем и органов | Нежелательные реакции | Частота возникновения |
| Общие расстройства и состояния в месте введения | Повышение температуры тела. | Редко |
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Сообщение о подозреваемых нежелательных реакциях
После разрешения препарата к обращению важно сообщать о подозреваемых нежелательных реакциях. Это позволяет непрерывно мониторить соотношение пользы и риска применения препарата. Лица, относящиеся к медицинскому персоналу, должны сообщать о всех подозреваемых нежелательных реакциях через:
- Отдел мониторинга нежелательных реакций препаратов Министерства здравоохранения
- Адрес: улица Джерозолимская, 181С, 02-222 Варшава
- Телефон: +48 222 49 21 301
- Факс: +48 222 49 21 309
- Электронная почта: [email protected]
Благодаря сообщению о нежелательных реакциях можно собрать больше информации о безопасности применения препарата.
5. ХРАНЕНИЕ ПРЕПАРАТА ФАНХДИ
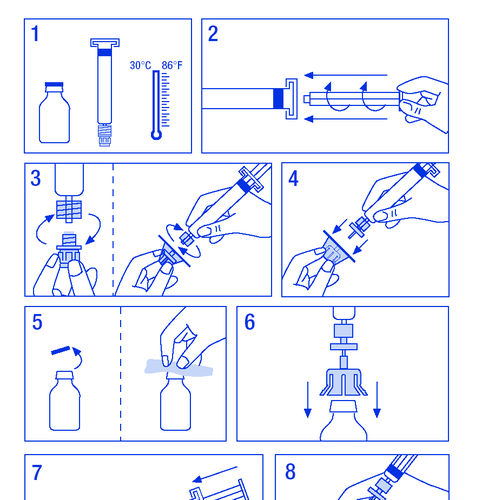
Препарат следует хранить в месте, недоступном для детей. Не хранить при температуре выше 30°C. Не замораживать. Не следует применять препарат после истечения срока годности. Раствор должен быть прозрачным и слегка опалесцирующим. Не применять растворы, в которых появляются хлопья или осадок. Не применять, если в продукте после растворения видны частицы или раствор изменил цвет. После восстановления химическая и физическая стабильность продукта сохраняется до 12 часов при температуре 25°C. С микробиологической точки зрения, продукт должен быть использован немедленно. Если после восстановления продукт не был использован, он может быть хранен не более 24 часов при температуре 2°C – 8°C, но только в том случае, если ответственность за это лежит на пользователе, и подготовка раствора была проведена в соответствии с правилами асептики.
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Препаратов не следует выбрасывать в канализацию. Необходимо спросить у фармацевта, как утилизировать препараты, которые больше не используются. Такое поведение поможет защитить окружающую среду.
Срок годности
3 года. Не следует применять препарат после истечения срока годности, указанного на этикетке.
6. СОСТАВ УПАКОВКИ И ДРУГИЕ СВЕДЕНИЯ
Что содержит препарат ФАНХДИ
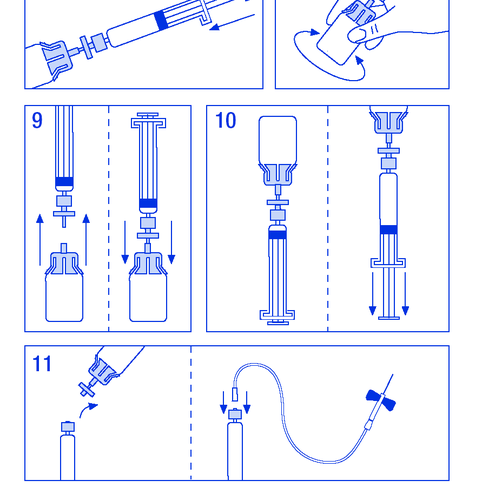
Активное вещество - комплекс человеческого фактора свёртывания крови VIII и фактора Виллебранда. Каждая флакона с порошком содержит 500 МЕ человеческого фактора свёртывания крови VIII и 600 МЕ фактора Виллебранда. После растворения в 10 мл воды для инъекций продукт содержит 50 МЕ/мл ФВIII и 60 МЕ/мл ФВФ. Другие компоненты: человеческий альбумин, гистидин и аргинин. Каждая ампула-шприц содержит 10 мл воды для инъекций.
Как выглядит препарат ФАНХДИ и что содержит упаковка
Флакона с белым или светло-жёлтым порошком и ампула-шприц с водой для инъекций. Каждая упаковка ФАНХДИ содержит флакону по 500 МЕ человеческого фактора свёртывания крови VIII и 600 МЕ фактора Виллебранда (порошок для инъекций и инфузий) и 1 ампула-шприц по 10 мл воды для инъекций (растворитель). Набор для приготовления раствора и введения включён в упаковку ФАНХДИ: соединитель для флаконы, фильтр и набор для инфузии. Доступные упаковки: ФАНХДИ 250 МЕ ФВIII + 300 МЕ ФВФ, ФАНХДИ 1000 МЕ ФВIII + 1200 МЕ ФВФ. Не все упаковки могут находиться в обращении.
Ответственное лицо и производитель
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Институт Грифолс, С.А. Кан Гваск, 2 - Паретс дель Вальес, 08150 Барселона, Испания. Для получения более подробной информации необходимо обратиться к местному представителю ответственного лица: Грифолс Польша Сп. з о.о., Ул. Гжибовская, 87, 00-844 Варшава, Телефон: +48 22 378 85 61
Дата последней актуализации инструкции:
…………………………………………………………………………………………………
Информация, предназначенная исключительно для медицинского персонала:
Дозирование
Дефицит фактора свёртывания крови VIII. Дозирование и продолжительность заместительной терапии зависят от степени дефицита фактора VIII, местоположения и тяжести кровотечения, а также от клинического состояния пациента. Введённую дозу фактора VIII выражают в международных единицах (МЕ) в соответствии с действующими нормами ВОЗ для препаратов, содержащих человеческий фактор VIII. Активность фактора VIII в сыворотке может быть выражена в процентах (относительно нормальной сыворотки) или в МЕ/мл. Одна международная единица (МЕ) активности фактора VIII соответствует количеству фактора VIII в 1 мл нормальной человеческой сыворотки.
Таблица дозирования
| Тяжесть кровотечения/тип хирургической операции | Требуемый уровень фактора VIII (%) (МЕ/мл) | Частота дозирования (часы)/продолжительность лечения (дни) |
| Кровотечение. Свежее кровотечение в суставы, мышцы или кровотечение из полости рта. Более тяжёлое кровотечение в суставы, мышцы или гематома. Кровотечения, угрожающие жизни. |
| Повторять каждые 12-24 часа, не менее 1 дня, до прекращения боли, вызванной кровотечением, или заживления раны. Повторять инфузии каждые 12-24 часа в течение 3-4 дней или дольше, до прекращения боли или нарушения функции. Повторять инфузии каждые 8-24 часа до прекращения угрозы |
| Хирургические операции. Меньшие, включая удаление зуба. Более крупные |
| Каждые 24 часа, не менее 1 дня, до заживления раны. Повторять инфузии каждые 8-24 часа до достижения адекватного заживления раны, затем продолжать лечение в течение следующих 7 дней, поддерживая активность фактора VIII на уровне от 30% до 60% (МЕ/мл) |
Профилактическое лечение. В долгосрочной профилактике кровотечений у пациентов с тяжёлой формой гемофилии А обычно применяется доза от 20 до 40 МЕ/кг массы тела с интервалом 2-3 дня. В некоторых случаях, особенно у пациентов молодого возраста, может возникнуть необходимость сокращения интервала между инъекциями или увеличения дозы.
- 1.3.1. Регистрационный удостоверение, маркировка и инструкция по применению
Во время лечения для определения дозы и частоты введения инфузий рекомендуется проводить соответствующие исследования для определения уровня фактора VIII в сыворотке. Особенно в случаях крупных хирургических операций необходимо тщательное мониторинг заместительной терапии с помощью исследований системы свёртывания крови (активность фактора VIII в сыворотке). Пациенты могут индивидуально реагировать на лечение фактором VIII, что отражается в различных уровнях восстановления in vivo и в различных периодах полувыведения у отдельных пациентов. Болезнь Виллебранда. Обычно принимается, что введение 1 МЕ ВФФ:РКо/кг массы тела приводит к увеличению уровня ВФФ:РКо на 2% в кровотоке. Цель лечения - достижение уровня ВФФ:РКо > 0,6 МЕ/мл (60%) и ФВIII:С > 0,4 МЕ/мл (40%) в сыворотке. В большинстве случаев для достижения гемостаза рекомендуется доза 40-80 МЕ/кг массы тела фактора Виллебранда и 20-40 МЕ/кг массы тела фактора VIII:С. Пациенты с болезнью Виллебранда типа 3, у которых для поддержания соответствующих уровней фактора может быть необходима более высокая доза, могут потребовать введения начальной дозы фактора Виллебранда 80 МЕ/кг массы тела. Рекомендуется вводить соответствующую дозу каждые 12-24 часа. Дозирование и продолжительность лечения зависят от клинического состояния пациента, местоположения и тяжести кровотечения, а также от уровня как ВФФ:РКо, так и ФВIII:С.
- Через 24-48 часов лечения необходимо рассмотреть возможность снижения дозы или увеличения интервала между дозами или применение препаратов, содержащих ВФФ и меньшее количество фактора VIII.
Дети и подростки. В вышеуказанном показании доступны только ограниченные данные клинических исследований у детей младше 6 лет, и поэтому нет рекомендаций по применению препарата в этой возрастной группе. У детей в вышеуказанных показаниях корректировка дозы в зависимости от эффективности клинической также основана на расчёте дозы в зависимости от массы тела.
- Страна регистрации
- Действующее вещество
- Отпускается по рецептуДа
- Производитель
- ИмпортерInstituto Grifols, S.A.
- Информация на этой странице носит справочный характер и не является медицинской консультацией. Перед началом приема лекарства обязательно проконсультируйтесь с врачом.
- Аналоги ФангдиФорма выпуска: Порошок, 25 МЕ/мл; 250 МЕ + 30 МЕ/мл; 300 МЕДействующее вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: Instituto Grifols S.A.Отпускается по рецептуФорма выпуска: Порошок, 100 МЕ/мл; 1000 МЕ + 120 МЕ/мл; 1200 МЕДействующее вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: Instituto Grifols S.A.Отпускается по рецептуФорма выпуска: Порошок, 1000 МЕ + 2400 МЕ/15 млДействующее вещество: Von Willebrand factor and coagulation factor VIII in combinationПроизводитель: CSL Behring GmbHОтпускается по рецепту
Аналоги Фангди в других странах
Лекарства с тем же действующим веществом, доступные в других странах.
Аналог Фангди в Украина
Врачи онлайн по Фангди
Обсудите применение Фангди и возможные следующие шаги — по оценке врача.
Часто задаваемые вопросы

Получайте обновления и полезные материалы
Новости о медицинских услугах, обновления сервиса и практическая информация для пациентов.