Artiss

Jak stosować Artiss
Tłumaczenie AI
Ta strona ma charakter informacyjny i nie zastępuje konsultacji lekarskiej. Przed zastosowaniem jakiegokolwiek leku skonsultuj się z lekarzem. Jeśli objawy są poważne, skorzystaj z pilnej pomocy medycznej.
Pokaż tłumaczenieTreść ulotki
- Ulotka dołączona do opakowania: informacja dla użytkownika
- ARTISS
- Roztwory do sporządzenia kleju do tkanek
- Głęboko mrożone
- Fibrynogen ludzki, trombina ludzka, aprotynina, wapnia chlorek dwuwodny
- Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
- Co to jest ARTISS i w jakim celu się go stosuje
- Informacje ważne przed zastosowaniem leku ARTISS
- Jak stosować lek ARTISS
- Podczas nanoszenia produktu ARTISS za pomocą urządzenia rozpylającego należy przestrzegać zaleceń producenta dotyczących ciśnienia oraz odległości od tkanki zgodnie z zakresami podanymi poniżej:
- Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz punkt 2).
- Zastosowanie większej niż zalecana dawki leku ARTISS
- Możliwe działania niepożądane
- Jak przechowywać lek ARTISS
- Zawartość opakowania i inne informacje
- Co zawiera lek ARTISS
- Jak wygląda lek ARTISS i co zawiera opakowanie
- Podmiot odpowiedzialny
- Wytwórca
- Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
- Obszaru Gospodarczego pod następującymi nazwami:
- Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
- Wpływ na płodność, ciążę i laktację
- Dawkowanie i sposób podawania
- Dawkowanie
- Sposób podawania
- Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania (opakowanie: Strzykawka PRIMA)
- Informacje ogólne
- Przygotowanie do stosowania
- Rozmrażanie/ogrzewanie szybkie (sterylna łaźnia wodna) – zalecana metoda:
- Rozmrażanie/ogrzewanie w niesterylnej łaźni wodnej
- Rozmrażanie/ogrzewanie w inkubatorze
- Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C) PRZED ogrzaniem
- Instrukcja:
- Stabilność po rozmrożeniu
- Obchodzenie się z produktem po rozmrożeniu/przed podaniem
- Podawanie nienatryskowe przy pomocy strzykawki PRIMA:
- Podawanie
- Nanoszenie produktu za pomocą urządzenia rozpylającego
- Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz Charakterystyka Produktu Leczniczego
- Usuwanie pozostałości
- Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania (opakowanie: Strzykawka AST)
- Informacje ogólne
- Przygotowanie do stosowania
- Instrukcja:
- Minimalny czas rozmrażania/ogrzewania
- 33°C do 37°C, sterylna łaźnia wodna produkt wyjęty z worków
- Instrukcja:
- Minimalny czas rozmrażania/ogrzewania
- 33°C do 37°C, niesterylna łaźnia wodna produkt w workach
- Instrukcja:
- Minimalny czas rozmrażania/ogrzewania
- 33°C do 37°C, inkubator produkt w workach
- Instrukcja:
- Minimalny czas rozmrażania produktu w temperaturze pokojowej (nieprzekraczającej 25°C) i czas ogrzewania w inkubatorze, przed użyciem, do temperatury od 33°C do
- Produkt w workach
- Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C)
- Ogrzewanie w inkubatorze (33°C-37°C)
- Stabilność po rozmrożeniu
- Obchodzenie się z produktem po rozmrożeniu/przed podaniem
- Podawanie nienatryskowe przy użyciu strzykawki AST:
- Podawanie
- Nanoszenie produktu za pomocą urządzenia rozpylającego
- Zalecane wartości ciśnienia i odległości od tkanki oraz urządzenia rozpylające służące do nanoszenia produktu ARTISS
- Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz Charakterystyka Produktu Leczniczego
- Usuwanie pozostałości
Ulotka dołączona do opakowania: informacja dla użytkownika
ARTISS
Roztwory do sporządzenia kleju do tkanek
Głęboko mrożone
Fibrynogen ludzki, trombina ludzka, aprotynina, wapnia chlorek dwuwodny
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
- 1. Co to jest lek ARTISS i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku ARTISS
- 3. Jak stosować lek ARTISS
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek ARTISS
- 6. Zawartość opakowania i inne informacje
1. Co to jest ARTISS i w jakim celu się go stosuje
Co to jest lek ARTISS
ARTISS jest dwuskładnikowym fibrynowym klejem do tkanek i zawiera dwa spośród białek, które
tworzą skrzep krwi. Białka te noszą nazwę fibrynogen i trombina. Gdy te białka mieszają się podczas
podawania, tworzą skrzep w miejscu, gdzie nałoży je chirurg.
ARTISS jest przygotowywany w postaci dwóch roztworów (roztwór białek klejących i roztwór
trombiny), które ulegają zmieszaniu podczas podawania.
W jakim celu stosuje się lek ARTISS
ARTISS jest klejem do tkanek.
ARTISS jest stosowany do sklejania tkanek miękkich w chirurgii plastycznej, rekonstrukcyjnej i w
leczeniu oparzeń. Na przykład, lek ARTISS może być użyty do sklejenia przeszczepów skóry lub
płatów skóry do ran po oparzeniach lub w chirurgii plastycznej do sklejenia skóry z leżącą poniżej
tkanką. Za pomocą leku ARTISS można także przykleić sztuczną skórę w miejscu rany.
Skrzep powstający z leku ARTISS jest bardzo podobny do naturalnego skrzepu krwi. Oznacza to, że
ulega on naturalnemu rozpuszczeniu i nie zostawia żadnych pozostałości. Tym niemniej, dodaje się
aprotyninę (białko, które opóźnia rozpuszczanie skrzepu) w celu zwiększenia trwałości skrzepu i
zapobieżenia jego przedwczesnemu rozpuszczeniu.
2. Informacje ważne przed zastosowaniem leku ARTISS
Nie stosować leku ARTISS:
- Jeśli pacjent ma uczulenie na substancje czynne lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- Nie należy stosować ARTISS do leczenia masywnych i intensywnych krwawień.
- Nie należy używać ARTISS w zastępstwie szwów na skórze służących do zamknięcia rany operacyjnej.
- Leku ARTISS NIE WOLNO wstrzykiwać do naczyń krwionośnych (żył lub tętnic), ani do tkanek. Ponieważ ARTISS tworzy skrzepy w miejscu, gdzie jest podany, wstrzyknięcie leku ARTISS może spowodować poważne reakcje (np. zamknięcie naczynia). ARTISS należy podawać wyłącznie na powierzchnie tkanek w postaci cienkiej warstwy, tam gdzie jest to potrzebne.
- Nie wolno podawać pacjentowi leku ARTISS w przypadku alergii (nadwrażliwości) na substancje czynne, na białko bydlęce lub jakikolwiek inny składnik (patrz punkt 6) leku ARTISS. Może to spowodować poważne reakcje alergiczne. Należy poinformować chirurga lub innego lekarza, jeśli pacjent wie, że jest uczulony na aprotyninę lub jakiekolwiek białko bydlęce.
- Aplikacja natryskowa ARTISS nie powinna być stosowana w procedurach endoskopowych. Stosowanie w laparoskopii (zabiegi chirurgiczne przez otwory w powłokach ciała), patrz punkt „Ostrzeżenia i środki ostrożności”.
Ostrzeżenia i środki ostrożności
- Przed rozpoczęciem stosowania ARTISS należy omówić to z lekarzem, farmaceutą lub pielegniarką.
- Podczas stosowania urządzeń rozpylających wyposażonych w regulator ciśnienia, w celunanoszenia fibrynowych klejów do tkanek, odnotowano występowanie zagrażającychżyciu lub powodujących zgon zatorów powietrznych i gazowych (polegających naprzedostaniu się powietrza do krwiobiegu, co może prowadzić do poważnego zagrożeniazdrowia lub życia). Wydaje się, że jest to związane ze stosowaniem urządzeniarozpylającego przy ustawieniach ciśnienia większych niż zalecane i (lub) bardzo bliskopowierzchni tkanki. Ryzyko wydaje się być większe, gdy fibrynowe kleje do tkanek sąrozpylane z powietrzem, niż gdy są rozpylane z CO. Z tego powodu nie można wykluczyćwystąpienia takiego zdarzenia wskutek rozpylania produktu ARTISS.
- Podczas nanoszenia produktu ARTISS za pomocą urządzenia rozpylającego ciśnienie iodległość rozpylania muszą się mieścić w zakresie zalecanym przez producentaurządzenia. Produkt ARTISS należy podawać ściśle według instrukcji oraz wyłącznie zapomocą urządzeń zalecanych do stosowania tego produktu.
- Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego,tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względuna możliwość wystąpienia zatoru gazowego.
- Nie należy stosować ARTISS z EasySpray/systemem Spray Set w zamkniętych obszarach ciała z poważnych względów bezpieczeństwa.
- ARTISS nie jest zalecany w zabiegach laparoskopowych (zabiegi chirurgiczne prowadzone przez otwory w powłokach ciała).
- ARTISS powinien być nakładany jedynie przy użyciu wyrobów oznakowanych znakiem CE.
- W przypadku stosowania z tym produktem końcowek pomocniczych, należy postępować zgodnie z instrukcjami używania tych końcówek.
- Jeżeli pacjent kiedykolwiek wcześniej otrzymywał lek ARTISS lub aprotyninę, jego organizm mógł stać się na nie wrażliwy. Istnieje możliwość, że pacjent może być uczulony na ten produkt, nawet jeżeli przy pierwszym podaniu nie wystąpiły żadne reakcje. Jeżeli pacjent uważa, że mógł otrzymać któryś z produktów przy poprzedniej operacji, musi poinformować o tym lekarza.
- Jeśli wystąpi jakikolwiek objaw reakcji alergicznej, lekarz natychmiast przerwie podawanie ARTISS i zastosuje odpowiednie leczenie.
- ARTISS nie jest wskazany do wspomagania hemostazy i klejenia tkanek w przypadkach, gdy wymagane jest szybkie krzepnięcie kleju. ARTISS nie powinien być stosowany zwłaszcza w zabiegach kardiochirurgicznych, w których zamierza się użyć kleju do zespoleń naczyniowych.
- ARTISS nie jest wskazany do stosowania w neurochirurgii ani jako materiał uszczelniający szwy w zespoleniach przewodu pokarmowego lub zespoleniach naczyniowych, ponieważ brak jest danych na poparcie tych wskazań.
- Przed nałożeniem leku ARTISS, okolice ciała leżące poza docelowym miejscem nałożenia produktu muszą być dostatecznie chronione/osłonięte, tak aby uniknąć niepożądanego złączenia tkanek.
- ARTISS jest stosowany w postaci cienkiej warstwy. Zbyt duża grubość skrzepu może niekorzystnie wpłynąć na skuteczność produktu oraz na proces gojenia się rany.
- Lekarz nie będzie stosował jako materiały nośne preparatów zawierających oksycelulozę, gdyż mogą one zmniejszać skuteczność ARTISS.
Kiedy leki wytwarzane są z ludzkiej krwi lub osocza, to podejmowane są określone środki
zapobiegania przenoszeniu zakażeń na pacjentów. Do tych środków zalicza się:
- dokładną selekcję dawców krwi i osocza, aby upewnić się, że ci, którzy są w grupie ryzyka nosicielstwa infekcji są wykluczeni,
- sprawdzanie pojedynczych próbek oddanej krwi i puli zebranego osocza pod kątem wirusów/infekcji,
- włączanie etapów, które inaktywują lub usuwają wirusy w procesie przetwarzania krwii lub osocza.
Pomimo takich środków, kiedy podawane są leki wytwarzane z ludzkiej krwi lub osocza nie można
całkowicie wykluczyć możliwości przeniesienia zakażenia. Dotyczy to również nieznanych lub nowo
odkrytych wirusów i innych rodzajów zakażeń.
Podejmowane środki uważane są za skuteczne wobec wirusów otoczkowych, takich jak ludzki wirus
niedoboru odporności (HIV), wirus zapalenia wątroby typu B i wirus zapalenia wątroby typu C, oraz
bezotoczkowego wirusa zapalenia wątroby typu A.
Podejmowane środki mogą mieć ograniczoną wartość wobec wirusów bezotoczkowych, takich jak
parwowirus B19. Zakażenie parwowirusem B19 może być groźne u kobiet w ciąży (zakażenie płodu) i
u osób z osłabionym układem odpornościowym lub u osób z niektórymi typami niedokrwistości (np.
sferocytoza wrodzona lub niedokrwistość hemolityczna).
Zdecydowanie zaleca się, aby przy każdorazowym podaniu pacjentowi dawki ARTISS odnotować
nazwę i numer serii produktu w celu zachowania informacji o zastosowanych seriach.
ARTISS a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować.
ARTISS może być stosowany równocześnie z innymi lekami przyjmowanymi przez pacjenta. Nie są
znane żadne interakcje leku ARTISS z innymi produktami leczniczymi.
Podobnie jak inne porównywalne preparaty lub roztwory trombiny, produkt może ulegać zniszczeniu
pod wpływem roztworów zawierających alkohol, jodynę lub metale ciężkie (np. roztwory odkażające).
Przed nałożeniem produktu należy jak najdokładniej usunąć tego rodzaju substancje.
ARTISS z jedzeniem i piciem
Należy zapytać lekarza. Lekarz zdecyduje, czy pacjent może jeść i pić przed podaniem leku ARTISS.
Ciąża i karmienie piersią
Jeżeli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza przed zastosowaniem tego leku. Lekarz zdecyduje, czy można
zastosować lek ARTISS w czasie ciąży lub karmienia piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
ARTISS nie ma wpływu na zdolność do prowadzenia pojazdów mechanicznych lub obsługi maszyn.
ARTISS zawiera Polisorbat 80
Polisorbat 80 może powodować alergię skórną (np. wysypka, swędzenie).
3. Jak stosować lek ARTISS
- ARTISS stosowany jest wyłącznie w trakcie operacji chirurgicznej. Produkt ARTISS może być stosowany wyłącznie przez doświadczonych chirurgów, którzy zostali w tym zakresie przeszkoleni.
- Ilość leku ARTISS, która zostanie użyta zależy od wielu czynników, w tym rodzaju zabiegu, rozmiaru powierzchni tkanki, którą obejmie zabieg oraz sposobu nakładania leku ARTISS. Chirurg zdecyduje jaka ilość jest odpowiednia.
- Podczas operacji chirurg nałoży lek ARTISS na właściwą powierzchnię tkanki, stosując specjalny dostarczony przyrząd do nakładania. Przyrząd ten zapewnia nałożenie w tym samym czasie równych ilości obu składników kleju fibrynowego, co jest ważne dla uzyskania optymalnego efektu leku ARTISS.
- Przed naniesieniem produktu ARTISS powierzchnię rany należy osuszyć, stosując standardowe techniki (np. wymiana kompresów, gazików, stosowanie urządzeń odsysających).
- ARTISS wolno rozpylać tylko na powierzchniach, które są widoczne.
- Zaleca się, aby wstępna aplikacja obejmowała cały obszar przeznaczony do pokrycia zamierzonego obszaru aplikacji.
Podczas nanoszenia produktu ARTISS za pomocą urządzenia rozpylającego należy przestrzegać zaleceń producenta dotyczących ciśnienia oraz odległości od tkanki zgodnie z zakresami podanymi poniżej:
| Zalecane wartości ciśnienia i odległości od tkanki oraz urządzenia rozpylające służące do nanoszenia produktu ARTISS | |||||
| Zestaw rozpylający, który ma być zastosowany | Końcówki aplikatora, które mają być zastosowane | Regulator ciśnienia, który ma być zastosowany | Zalecana odległość od tkanki docelowej | Zalecane ciśnienie rozpylania | |
| Leczenie chirurgiczne ran otwartych obejmujących tkankę podskórną | Zestaw rozpylający Tisseel/Artiss | nd. | EasySpray | 10–15 cm | 1,5– 2,0 barów (21,5– 28,5 psi) |
| Zestaw rozpylający Tisseel/Artiss — opakowanie 10 szt. | nd. | EasySpray | |||
Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz punkt 2).
Zastosowanie większej niż zalecana dawki leku ARTISS
ARTISS stosowany jest wyłącznie w trakcie operacji chirurgicznej. Jest nakładany przez chirurga i
ilość leku ARTISS jest też ustalana przez chirurga.
W razie jakichkolwiek pytań odnośnie stosowania leku należy zwrócić się do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Podobnie jak wszystkie leki, lek ten może wywołać działania niepożądane, chociaż nie u każdego one
wystąpią.
W tabeli wyjaśniono jak należy rozumieć poszczególne częstości, jak podano w poniższej sekcji:
Bardzo często: może dotyczyć więcej niż 1 pacjenta na 10
Często: może dotyczyć maks. 1 na 10 pacjentów
Niezbyt często: może dotyczyć maks. 1 na 100 pacjentów
Rzadko: może dotyczyć maks. 1 na 1000 pacjentów
Bardzo rzadko: może dotyczyć maks. 1 na 10 000 pacjentów
Nieznana: częstość nie może być określona na podstawie dostępnych danych
- Istnieje niewielka możliwość wystąpienia u pacjenta reakcji alergicznej na jeden ze składników leku ARTISS (patrz punkt 6). Jest to bardziej prawdopodobne, jeżeli pacjent był wcześniej leczony za pomocą ARTISS lub aprotyniny podczas wcześniejszej operacji. Reakcje alergiczne mogą być ciężkie i jest bardzo ważne, aby dokładnie omówić z lekarzem możliwość ich wystąpienia.
- Mogą wystąpić reakcje typu anafilaktycznego/anafilaktoidalnego, ich częstość nie jest znana. Wczesnymi objawami reakcji alergicznych mogą być: nagłe zaczerwienienie, spadek ciśnienia krwi, przyspieszenie lub zwolnienie tętna, nudności (uczucie mdłości), pokrzywka, swędzenie, trudności w oddychaniu.
- Zespół przeprowadzający zabieg chirurgiczny jest świadomy ryzyka tego typu reakcji - jeśli zauważą jakiekolwiek objawy, podawanie leku ARTISS zostanie natychmiast wstrzymane. Ciężkie objawy mogą wymagać podjęcia środków ratunkowych. Częstość reakcji alergicznych nie jest znana.
- Wstrzyknięcie leku ARTISS do tkanek miękkich może spowodować miejscowe uszkodzenie tkanki. Częstość nie jest znana.
- Wstrzyknięcie leku ARTISS do naczyń krwionośnych (żył lub tętnic) może spowodować powstanie zakrzepów (zakrzepicę). Częstość nie jest znana.
- Ponieważ lek ARTISS jest wytwarzany z osocza pochodzącego z krwi od dawców, nie można całkowicie wykluczyć ryzyka zakażenia, ale wytwórca podejmuje liczne środki, aby zmniejszyć to ryzyko (patrz punkt 2).
- Zagrażające życiu/zakończone zgonem przypadki zatoru spowodowanego powietrzem lub gazem (powietrze dostaje się do krążenia krwi, co może być poważnym stanem lub zagrażającym życiu) wystąpiły przy stosowaniu urządzeń rozpylających wykorzystujących regulatory ciśnienia do podawania klejów fibrynowych. Wydaje się, że jest to związane ze stosowaniem urządzenia rozpylającego przy wyższych niż zalecane ciśnieniach i (lub) w bliższej niż zalecana odległości od powierzchni tkanek.
Działania niepożądane zgłaszane w trakcie badań klinicznych ARTISS oraz po wprowadzeniu do
obrotu klejów fibrynowych firmy Baxter zestawiono poniżej. Podane częstości działań niepożądanych
oparte są na danych z kontrolowanego badania klinicznego przeprowadzonego na 138 pacjentach, w
którym za pomocą produktu ARTISS przytwierdzano przeszczepy skóry w miejsce wyciętych ran
oparzeniowych. Żadne z działań obserwowanych w badaniu klinicznym nie zostało zakwalifikowane
jako ciężkie.
| Tabela 1 Działania niepożądane | |
| Działanie niepożądane | Częstość |
| Torbiel skórna | Niezbyt często |
| Swędzenie | Często |
| Niepowodzenie przeszczepu skóry | Często |
| Pęcherzyki gazu w układzie naczyniowym (zator powietrzny)* | Nieznana |
*występowanie pęcherzyków powietrza lub gazu w układzie naczyniowym miało miejsce gdy kleje
fibrynowe są nakładane przy stosowaniu urządzeń ze sprężonym powietrzem lub gazem; wydaje się to
być powiązane z nieprawidłowym zastosowaniem urządzenia rozpylającego (np. o wyższym niż
zalecane ciśnieniu oraz w bliższej niż zalecana odległości od powierzchni tkanki).
Poniższe działania niepożądane były zgłaszane dla innych klejów tkankowych, ich częstość nie może
być określona: alergia, ciężka reakcja alergiczna, wolne bicie serca, szybkie bicie serca, obniżenie
ciśnienia krwi, wysięk krwi, spłycenie oddechu, nudności, pokrzywka, nagłe zaczerwienienie,
zaburzenie gojenia, obrzęk, gorączka oraz nagromadzenie limfy i innych płynów ciała pod skórą w
okolicy miejsca zabiegu.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce.
Działania
niepożądane
można
zgłaszać
bezpośrednio
do
Departamentu
Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek ARTISS
- Przechowywać ten lek w miejscu niewidocznym i niedostępnym dla dzieci.
- Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie po „EXP”.
- Przechowywać i transportować w stanie zamrożonym (w temperaturze -20 C), w niezmienionych warunkach, aż do momentu przygotowania do użycia.
- Przechowywać strzykawkę w oryginalnym opakowaniu w celu ochrony przed światłem.
Przechowywanie po rozmrożeniu
Produkt w nieotwartych workach ochronnych, rozmrożony w temperaturze pokojowej, może być
przechowywany do 14 dni w kontrolowanej temperaturze pokojowej (nieprzekraczającej 25°C).
Po rozmrożeniu nie zamrażać ponownie ani nie umieszczać w lodówce!
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek ARTISS
ARTISS zawiera dwa składniki:
Składnik 1 = Roztwór białek klejących:
Substancjami czynnymi zawartymi w 1 ml roztworu białek klejących są:
Fibrynogen ludzki, 91 mg/ml wytwarzany z osocza dawców ludzkich; syntetyczna aprotynina 3000
KIU/ml
Substancjami pomocniczymi są: albumina ludzka, L-Histydyna, amid kwasu nikotynowego,
polisorbat 80, sodu cytrynian dwuwodny i woda do wstrzykiwań.
Składnik 2 = Roztwór trombiny:
Substancjami czynnymi zawartymi w 1 ml roztworu trombiny są:
Trombina ludzka, 4 j.m./ml wytwarzana z osocza dawców ludzkich; wapnia chlorek dwuwodny,
40 µmol/ml
Substancjami pomocniczymi są: albumina ludzka, sodu chlorek i woda do wstrzykiwań.
| Po zmieszaniu | 1 ml | 2 ml | 4 ml | 10 ml |
| Składnik 1: Roztwór białek klejących Fibrynogen ludzki (jako białko wykrzepiające) Aprotynina (syntetyczna) | 45,5 mg 1500 KIU | 91 mg 3000 KIU | 182 mg 6000 KIU | 455 mg 15000 KIU |
| Składnik 2: Roztwór trombiny Trombina ludzka Wapnia chlorek dwuwodny | 2 j.m. 20 mol | 4 j.m. 40 mol | 8 j.m. 80 mol | 20 j.m. 200 mol |
ARTISS zawiera czynnik XIII ludzki, współoczyszczany z fibrynogenem ludzkim, w ilościach 0,6 – 5
j.m./ml.
Jak wygląda lek ARTISS i co zawiera opakowanie
Roztwory do sporządzania kleju do tkanek.
Zamrożone roztwory do sporządzenia kleju do tkanek (1 ml, 2 ml lub 5 ml roztworu białek klejących i
1 ml, 2 ml lub 5 ml roztworu trombiny w dwukomorowej strzykawce jednorazowego użycia
umieszczonej w worku).
Wielkość opakowania 1 sztuka.
Zawartość opakowania ze strzykawką PRIMA:
1 ml, 2 ml lub 5 ml roztworu białek klejących i 1 ml, 2 ml lub 5 ml roztworu trombiny w wypełnionej
strzykawce dwukomorowej (polipropylenowej) jednorazowego użycia, zamkniętej korkiem i
pakowanej w dwa worki wraz z zestawem składającym się z 2 łączników i 4 igieł aplikacyjnych.
Zawartość opakowania ze strzykawką AST:
1 ml, 2 ml lub 5 ml roztworu białek klejących i 1 ml, 2 ml lub 5 ml roztworu trombiny w wypełnionej
strzykawce dwukomorowej (polipropylenowej) jednorazowego użycia, zamkniętej korkiem i
pakowanej w dwa worki wraz z zestawem składającym się z 1 podwójnego tłoka strzykawkowego, 2
łączników, 4 igieł aplikacyjnych.
Roztwór jest bezbarwny lub blado żółty.
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Warszawa
Wytwórca
Takeda Manufacturing Austria AG
Industriestrasse 67
A-1221 Wiedeń
Austria
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
ARTISSw następujących krajach: Austria, Belgia, Czechy, Niemcy, Grecja, Hiszpania, Finlandia,
Francja, Irlandia, Włochy, Luksemburg, Holandia, Norwegia, Polska, Portugalia, Wielka Brytania
(Irlandia Północna)
Artiss:Dania, Islandia, Szwecja
Data ostatniej aktualizacji ulotki:styczeń 2022
------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Wpływ na płodność, ciążę i laktację
Nie
przeprowadzono
dotychczas
kontrolowanych
badań
klinicznych
określających
bezpieczeństwo stosowania klejów fibrynowych/środków hemostatycznych u kobiet w ciąży lub
karmiących piersią. Nie przeprowadzano także badań na zwierzętach.
Z tego względu produkt może być stosowany u kobiet w ciąży lub karmiących piersią wyłącznie,
gdy jest to wyraźnie konieczne.
Nie ustalono wpływu ARTISS na płodność.
Dawkowanie i sposób podawania
ARTISS może być stosowany wyłącznie w lecznictwie zamkniętym. Produkt ARTISS może być
stosowany wyłącznie przez doświadczonych chirurgów, którzy zostali w tym zakresie
przeszkoleni.
Dawkowanie
Objętość oraz częstotliwość nakładania leku ARTISS należy zawsze dostosować do potrzeb wynikających
ze stanu klinicznego pacjenta.
Dawka, której należy użyć, zależy od różnych zmiennych, w tym między innymi od rodzaju zabiegu
chirurgicznego, wielkości klejonej powierzchni oraz wybranego sposobu nakładania kleju i ilości
aplikacji.
Nakładanie produktu musi być ustalone indywidualnie przez lekarza prowadzącego. W badaniach
klinicznych, indywidualnie dobierane dawki wynosiły zazwyczaj od 0,2 do 12 ml. W niektórych
zabiegach (np. zaopatrywanie rozległych ran oparzeniowych) konieczne może być zastosowanie
większych objętości preparatu.
Wstępna dawka produktu nałożona na wybrane miejsce anatomiczne ciała lub na docelową
powierzchnię powinna wystarczyć do całkowitego pokrycia zamierzonego obszaru aplikacji kleju. W
razie konieczności, nakładanie produktu można powtórzyć na małe obszary, które mogły nie zostać
wcześniej pokryte. Należy jednak unikać ponownego nakładania ARTISS na wcześniej istniejącą
spolimeryzowaną warstwę ARTISS, ponieważ ARTISS nie będzie przylegał do warstwy
spolimeryzowanej.
Zaleca się, aby wstępna aplikacja obejmowała cały obszar przeznaczony do pokrycia zamierzonego
obszaru aplikacji.
Jako wytyczną przy klejeniu powierzchni można przyjąć, że 1 opakowanie leku ARTISS 2 ml (tj. 1 ml
roztworu białek klejących plus 1 ml roztworu trombiny) wystarcza do pokrycia powierzchni co najmniej
10 cm .
Przeszczep skóry powinien zostać przymocowany do rany natychmiast po zaaplikowaniu ARTISS.
Chirurg ma do 60 sekund na manewrowanie i umiejscowienie przeszczepu przed polimeryzacją. Po
umiejscowieniu płatu lub przeszczepu, należy przytrzymać w pożądanej pozycji przez delikatne
ściśnięcie przez co najmniej 3 minuty, aby zapewnić prawidłowe związanie się ARTISS i mocne
przyleganie przeszczepu lub płatu do leżącej poniżej tkanki.
Wymagana ilość produktu ARTISS zależy od powierzchni jaką ma on pokryć. Przybliżona
powierzchnia jaką pokrywa dana wielkość opakowania produktu ARTISS w aplikacji natryskowej jest
następująca:
| Przybliżona powierzchnia do przyklejenia tkanki | Wymagana wielkość opakowania ARTISS |
| 100 cm2 200 cm2 500 cm2 | 2 ml 4 ml 10 ml |
Aby uniknąć nadmiernego ziarninowania i aby zapewnić stopniowe wchłanianie się zestalonego kleju
do tkanek, należy nakładać tylko bardzo cienkie warstwy mieszaniny roztworu białek klejących i
trombiny.
ARTISS nie był stosowany w badaniach klinicznych u osób powyżej 65 roku życia.
Populacja pediatryczna
Obecnie dostępne dane są opisane w punkcie 5.1 Charakterystyki Produktu Leczniczego, ale nie
można podać zaleceń dotyczących dawkowania.
Sposób podawania
Na zmianę chorobową (miejscowo). Nie wstrzykiwać.
Wyłącznie do podania podskórnego. Produkt ARTISS nie jest zalecany do stosowania w zabiegach
laparoskopowych.
W celu zapewnienia optymalnych warunków bezpieczeństwa podczas stosowania produktu ARTISS
należy go nakładać za pomocą urządzenia wyposażonego w regulator ciśnienia, które wytwarza
ciśnienie o maksymalnej wartości 2,0 bara (28,5 psi).
Przed naniesieniem produktu ARTISS powierzchnię rany należy osuszyć, stosując standardowe
techniki (np. wymiana kompresów, gazików, stosowanie urządzeń odsysających). Do osuszania
powierzchni nie wolno stosować sprężonego powietrza lub gazu.
ARTISS wolno rozpylać tylko na powierzchniach, które są widoczne.
Produkt ARTISS należy rozpuszczać i podawać zgodnie z instrukcjami oraz przy użyciu urządzeń
zalecanych do stosowania z tym produktem.
W przypadku nanoszenia produktu przez rozpylanie, patrz poniżej punkt Podawanie.
Przed zastosowaniem ARTISS należy zwrócić uwagę, czy okolice ciała leżące poza docelowym
miejscem nałożenia produktu są dostatecznie zabezpieczone/osłonięte, tak aby uniknąć złączenia
tkanek w niepożądanych miejscach.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania (opakowanie: Strzykawka PRIMA)
Informacje ogólne
- Przed nałożeniem ARTISS należy osłonić okolice ciała leżące poza docelowym miejscem nałożenia preparatu, tak aby uniknąć złączenia tkanek w niepożądanych miejscach.
- Aby zapobiec przywarciu ARTISS do rękawiczek oraz narzędzi chirurgicznych, należy zwilżyć je roztworem soli fizjologicznej przed zetknięciem z klejem.
- Jako wytyczną przy klejeniu powierzchni można przyjąć, że 1 zestaw kleju ARTISS 2 ml (tj. 1 ml roztworu białek klejących plus 1 ml roztworu trombiny) wystarcza do pokrycia obszaru co najmniej 10 cm .
- Wymagana dawka zależy od rozmiaru klejonej powierzchni.
- NIE stosować dwóch składników produktu ARTISS oddzielnie. Oba składniki muszą być stosowane razem.
- Nie wystawiać produktu ARTISS na działanie temperatury powyżej 37°C. NIE poddawać działaniu mikrofal.
- NIE rozmrażać produktu poprzez trzymanie w dłoniach.
- NIE stosować produktu ARTISS do czasu całkowitego rozmrożenia i ogrzania do temperatury 33°C - 37°C.
- Zdjąć ochronną nasadkę ze strzykawki dopiero po zakończeniu rozmrażania i ogrzewania. Aby ułatwić zdejmowanie nasadki ochronnej ze strzykawki, przesuwać nasadkę ochronną do przodu i do tyłu, a następnie zdjąć nasadkę ochronną ze strzykawki.
- Usunąć całe powietrze ze strzykawki, a następnie zamocować łącznik i igłę aplikacyjną.
Przygotowanie do stosowania
Wewnętrzny worek i jego zawartość są jałowe, chyba że została naruszona integralność zewnętrznej
części opakowania. Z użyciem jałowej techniki, należy przenieść jałowy wewnętrzny worek i jego
zawartość na obszar sterylny.
Gotową do użycia strzykawkę można rozmrażać ORAZ ogrzewać jedną z poniższych metod:
- 1.Rozmrażanie/ogrzewanie szybkie (sterylna łaźnia wodna) –zalecana metoda
- 2. Rozmrażanie/ogrzewanie w niesterylnej łaźni wodnej
- 3. Rozmrażanie/ogrzewanie w inkubatorze
- 4. Gotową do użycia strzykawkę można także rozmrażać i przechowywać w temperaturze pokojowej (nieprzekraczającej 25°C) do 14 dni. Przed użyciem wymagane jest ogrzanie.
1. Rozmrażanie/ogrzewanie szybkie (sterylna łaźnia wodna) – zalecana metoda:
Zaleca się, aby rozmrażać i ogrzewać oba składniki kleju stosując sterylną łaźnię wodną w
temperaturze 33°C – 37°C.
- Temperatura łaźni wodnej nie może przekroczyć 37°C. Aby kontrolować określony przedział temperatur, konieczna jest kontrola temperatury wody za pomocą termometru oraz wymieniana wody w razie konieczności.
- Jeżeli do rozmrażania i ogrzewania stosuje się sterylną łaźnię wodną, należy wyjąć strzykawkę z worka przed umieszczeniem jej w sterylnej łaźni wodnej.
Instrukcja:
Przenieść wewnętrzny worek do warunków sterylnych, wyjąć gotową do użycia strzykawkę z worka
wewnętrznego i umieścić bezpośrednio w sterylnej łaźni wodnej. Upewnić się, że zawartość gotowej
do użycia strzykawki jest całkowicie zanurzona w wodzie.
Tabela 1: Minimalny czas rozmrażania i ogrzewania w sterylnej łaźni wodnej
| Wielkość opakowania | Minimalny czas rozmrażania/ogrzewania 33°C do 37°C, sterylna łaźnia wodna produkt wyjęty z worków |
| 2 ml | 5 minut |
| 4 ml | 5 minut |
| 10 ml | 10 minut |
2. Rozmrażanie/ogrzewanie w niesterylnej łaźni wodnej
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych umieścić w łaźni wodnej poza obszarem
sterylnym na odpowiedni czas (patrz Tabela 2). Należy upewnić się, że worki pozostają zanurzone w
wodzie podczas całego czasu rozmrażania. Po rozmrożeniu wyjąć worki z łaźni wodnej, osuszyć
zewnętrzny worek i przenieść wewnętrzny worek z gotową do użycia strzykawką do obszaru
sterylnego.
Tabela 2: Minimalny czas rozmrażania i ogrzewania w niesterylnej łaźni wodnej
| Wielkość opakowania | Minimalny czas rozmrażania/ogrzewania 33°C do 37°C, niesterylna łaźnia wodna produkt w workach |
| 2 ml | 15 minut |
| 4 ml | 20 minut |
| 10 ml | 35 minut |
3. Rozmrażanie/ogrzewanie w inkubatorze
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych umieścić w inkubatorze poza obszarem
sterylnym na odpowiedni czas (patrz Tabela 3). Po rozmrożeniu/ogrzaniu wyjąć worki z inkubatora,
zdjąć zewnętrzny worek i przenieść wewnętrzny worek z gotową do użycia strzykawką do obszaru
sterylnego.
Tabela 3: Minimalny czas rozmrażania i ogrzewania w inkubatorze
| Wielkość opakowania | Minimalny czas rozmrażania/ogrzewania 33°C do 37°C, inkubator produkt w workach |
| 2 ml | 40 minut |
| 4 ml | 50 minut |
| 10 ml | 90 minut |
4. Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C) PRZED ogrzaniem
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych rozmrozić w temperaturze pokojowej poza
obszarem sterylnym przez odpowiedni czas (patrz Tabela 4). Po rozmrożeniu, w celu ogrzania
produktu do użycia, ogrzać go w worku zewnętrznym w inkubatorze. Po rozmrożeniu w temperaturze
pokojowej, maksymalny czas przechowywania produktu (w obu workach) w temperaturze pokojowej
wynosi 14 dni.
Tabela 4: Minimalny czas rozmrażania w temperaturze pokojowej poza obszarem sterylnym i czas
dodatkowego ogrzewania, w inkubatorze do temperatury od 33°C do 37°C
| Wielkość opakowania | Minimalny czas rozmrażania produktu w temperaturze pokojowej (nieprzekraczającej 25°C) i czas ogrzewania w inkubatorze, przed użyciem, do temperatury od 33°C do maksimum 37°C Produkt w workach | |
| Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C) | Ogrzewanie w inkubatorze (33°C-37°C) | |
| 2 ml | 80 minut | + 11 minut |
| 4 ml | 90 minut | + 13 minut |
| 10 ml | 160 minut | + 25 minut |
Stabilność po rozmrożeniu
Po rozmrożeniu i ogrzaniu(w temperaturze od 33°C do 37°C, metody 1, 2 i 3), wykazano stabilność
chemiczną i fizyczną produktu przez 4 godziny w temperaturze od 33°C do 37°C.
Dla produktu rozmrożonegow temperaturze pokojowej, w nieotwartym worku (metoda 4), wykazano
stabilność chemiczną i fizyczną produktu przez 14 dni w temperaturze nieprzekraczającej 25°C.
Ogrzać do temperatury 33°C do 37°C bezpośrednio przed użyciem.
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast po ogrzaniu do temperatury
33°C
do
37°C,
chyba
że
metoda
otwierania/rozmrażania
wyklucza
ryzyko
zakażenia
mikrobiologicznego.
Jeśli produkt nie zostanie zużyty natychmiast, za czas i warunki przechowywania odpowiada
użytkownik.
Nie wolno ponownie zamrażać ani umieszczać w lodówce po rozpoczęciu rozmrażania.
Obchodzenie się z produktem po rozmrożeniu/przed podaniem
Aby uzyskać optymalne zmieszanie dwóch roztworów i optymalne zestalenie kleju fibrynowego,
należy utrzymywać temperaturę obu składników kleju na poziomie 33°C - 37°C do czasu
nałożenia.
Roztwór białek klejących i roztwór trombiny powinny być przezroczyste lub lekko opalizujące.
Nie wolno stosować roztworów mętnych lub zawierających osad. Rozmrożone produkty należy przed
zastosowaniem poddać ocenie wzrokowej pod kątem obecności nierozpuszczalnych cząstek oraz
zmiany barwy lub jakiejkolwiek zmiany w wyglądzie fizycznym. W przypadku wystąpienia jednej z
powyższych sytuacji, roztwór należy wyrzucić.
Rozmrożony roztwór białek klejących powinien być lekko lepkim płynem. Jeżeli roztwór ma postać
zestalonego żelu, należy przypuszczać, że uległ on denaturacji (prawdopodobnie na skutek przerwania
zimnego łańcucha przechowywania lub przegrzania podczas ogrzewania). W takim przypadku
NIE wolno pod żadnym warunkiem zastosować ARTISS.
- Wyjąć strzykawkę z worków bezpośrednio przed użyciem.
- ARTISS stosować tylko po całkowitym rozmrożeniu i ogrzaniu (płynna konsystencja).
- Nasadkę ochronną usunąć ze strzykawki dopiero bezpośrednio przed nakładaniem. Strzykawka PRIMA: Aby ułatwić zdejmowanie nasadki ochronnej ze strzykawki, przesuwać nasadkę ochronną do przodu i do tyłu, a następnie zdjąć nasadkę ochronną ze strzykawki.
Podawanie nienatryskowe przy pomocy strzykawki PRIMA:
W celu nałożenia kleju, połączyć dwukomorową gotową do użycia strzykawkę wypełnioną roztworem
białek klejących i roztworem trombiny z łącznikiem i igłą aplikacyjną, dostarczonymi w załączonym
zestawie przyrządów. Wspólny tłok dwukomorowej gotowej do użycia strzykawki zapewnia
podawanie do łącznika jednakowych objętości obu składników kleju, które następnie zostają
zmieszane w igle aplikacyjnej i następnie nałożone.
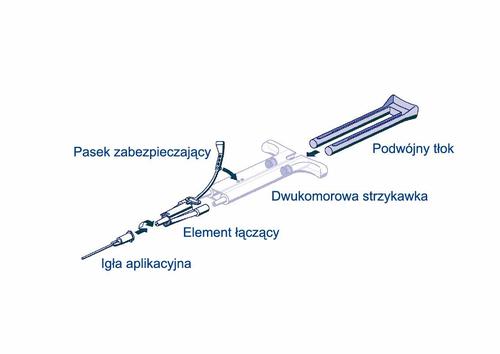
Instrukcja obsługi strzykawki PRIMA:
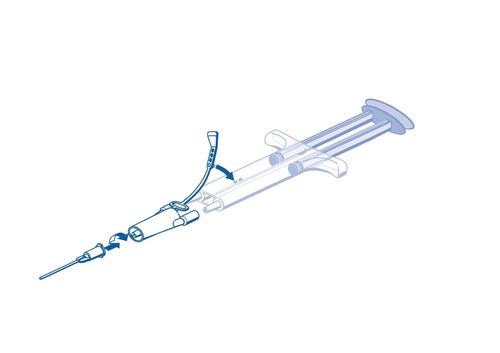
Pasek zabezpieczający
Podwójny tłok
Dwukomorowa strzykawka
Element łączący
Igła aplikacyjna
- Usunąć całe powietrze ze strzykawki przed podłączeniem do urządzenia podającego
- Podłączyć łącznik i pasek do boku strzykawki z otworem na pasek zabezpieczający.
- Połączyć wyloty dwukomorowej gotowej do użycia strzykawki z łącznikiem, upewniając się, że są odpowiednio zamocowane. o Zabezpieczyć łącznik, mocując pasek zabezpieczający do gotowej do użycia dwukomorowej strzykawki. o W razie rozerwania paska zabezpieczającego wykorzystać dodatkowy łącznik zawarty w zestawie. o Jeśli nie ma już dodatkowego łącznika, zestaw może być w dalszym ciągu stosowany, jeśli zwróci się uwagę, żeby połączenie było trwałe i szczelne. o NIE usuwać powietrza pozostałego w łączniku.
- Zamocować igłę aplikacyjną do łącznika. o NIE usuwać powietrza z łącznika ani z igły aplikacyjnej przed rozpoczęciem właściwego nakładania kleju, gdyż w przeciwnym razie mogłoby to spowodować zatkanie igły.
Podawanie
Przed naniesieniem produktu ARTISS powierzchnię rany należy osuszyć, stosując standardowe
techniki (np. wymiana kompresów, gazików, stosowanie urządzeń odsysających). Do osuszania
powierzchni nie wolno stosować sprężonego powietrza lub gazu.
- Nałożyć zmieszany roztwór białka klejące - trombina na powierzchnię docelową lub powierzchnie, które mają być sklejone, wolno uciskając tylną część wspólnego tłoka.
- W zabiegach chirurgicznych, które wymagają stosowania minimalnych objętości kleju fibrynowego, zaleca się wyciśnięcie i usunięcie pierwszych kilku kropel produktu.
- Po nałożeniu ARTISS, odczekać co najmniej 3 minuty do osiągnięcia dostatecznej polimeryzacji.
Uwaga: Jeżeli nakładanie składników kleju fibrynowego zostanie przerwane, igła może ulec
natychmiastowemu zatkaniu. W takim przypadku igłę aplikacyjną należy wymienić na nową
dopiero bezpośrednio przed ponownym nałożeniem kleju. Jeśli niedrożne są ujścia łącznika,
należy wykorzystać dodatkowy łącznik znajdujący się w opakowaniu.
Aplikacja jest także możliwa przy użyciu innych przyrządów dostarczanych przez BAXTER,
które są specjalnie dostosowane do np. nakładania na duże lub trudno dostępne
powierzchnie. Stosując tego rodzaju przyrządy do aplikacji, należy dokładnie przestrzegać
ich Instrukcji używania.
W celu uzyskania dalszych instrukcji dotyczących przygotowania należy zwrócić się do
pielęgniarki lub lekarza.
Nanoszenie produktu za pomocą urządzenia rozpylającego
Regulator ciśnienia powinien być stosowany zgodnie z instrukcją producenta.
Podczas nanoszenia produktu ARTISS za pomocą urządzenia rozpylającego należy przestrzegać
ciśnienia oraz odległości od tkanki zgodnie z zalecaniami producenta, jak poniżej:
| Zalecane wartości ciśnienia i odległości od tkanki oraz urządzenia rozpylające służące do nanoszenia produktu ARTISS | |||||
| Zestaw rozpylający, który ma być zastosowany | Końcówki aplikatora, które mają być zastosowane | Regulator ciśnienia, który ma być zastosowany | Zalecana odległość od tkanki docelowej | Zalecane ciśnienie rozpylania | |
| Leczenie chirurgiczne rany otwartej tkanki podskórnej | Zestaw rozpylający Tisseel/Artiss | nd. | EasySpray | 10–15 cm | 1,5– 2,0 barów (21,5– 28,5 psi) |
| Zestaw rozpylający Tisseel/Artiss — opakowanie 10 szt. | nd. | EasySpray | |||
Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz Charakterystyka Produktu Leczniczego
punkty 4.2 i 4.4).
W przypadku stosowania końcówek pomocniczych z tym produktem, należy postępować zgodnie z
instrukcjami używania końcówek.
Usuwanie pozostałości
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania (opakowanie: Strzykawka AST)
Informacje ogólne
- Przed nałożeniem ARTISS należy osłonić okolice ciała leżące poza docelowym miejscem nałożenia preparatu, tak aby uniknąć złączenia tkanek w niepożądanych miejscach.
- Aby zapobiec przywarciu ARTISS do rękawiczek oraz narzędzi chirurgicznych, należy zwilżyć je roztworem soli fizjologicznej przed zetknięciem z klejem.
- Jako wytyczną przy klejeniu powierzchni można przyjąć, że 1 zestaw kleju ARTISS 2 ml (tj. 1 ml roztworu białek klejących plus 1 ml roztworu trombiny) wystarcza do pokrycia obszaru co najmniej 10 cm2.
- Wymagana dawka zależy od rozmiaru klejonej powierzchni.
- NIE stosować dwóch składników produktu ARTISS oddzielnie. Oba składniki muszą być stosowane razem.
- Nie wystawiać produktu ARTISS na działanie temperatury powyżej 37°C. NIE poddawać działaniu mikrofal.
- NIE rozmrażać produktu poprzez trzymanie w dłoniach.
- NIE stosować produktu ARTISS do czasu całkowitego rozmrożenia i ogrzania do temperatury 33°C - 37°C.
- Zdjąć ochronną nasadkę ze strzykawki dopiero po zakończeniu rozmrażania i ogrzewania.
- Usunąć całe powietrze ze strzykawki, a następnie zamocować łącznik i igłę aplikacyjną.
Przygotowanie do stosowania
Wewnętrzny worek i jego zawartość są jałowe, chyba że została naruszona integralność zewnętrznej
części opakowania. Z użyciem jałowej techniki, należy przenieść jałowy wewnętrzny worek i jego
zawartość na obszar sterylny.
Gotową do użycia strzykawkę można rozmrażać ORAZ ogrzewać jedną z poniższych metod:
- 1. Rozmrażanie/ogrzewanie szybkie (sterylna łaźnia wodna) –zalecana metoda
- 2. Rozmrażanie/ogrzewanie w niesterylnej łaźni wodnej
- 3. Rozmrażanie/ogrzewanie w inkubatorze
- 4. Gotową do użycia strzykawkę można także rozmrażać i przechowywać w temperaturze pokojowej (nieprzekraczającej 25°C) przez maksymalnie 14 dni. Przed użyciem wymagane jest ogrzanie.
- 1) Rozmrażanie/ogrzewanie szybkie (sterylna łaźnia wodna) –zalecana metoda
Zaleca się, aby rozmrażać i ogrzewać oba składniki kleju stosując sterylną łaźnię wodną w
temperaturze 33°C – 37°C.
- Temperatura łaźni wodnej nie może przekroczyć 37°C. Aby kontrolować określony przedział temperatur, temperatura wody powinna być na bieżąco sprawdzana za pomocą termometru, a woda wymieniana w razie konieczności.
- Jeżeli do rozmrażania i ogrzewania stosuje się sterylną łaźnię wodną, należy wyjąć strzykawkę z worka przed umieszczeniem jej w sterylnej łaźni wodnej.
Instrukcja:
Przenieść wewnętrzny worek do warunków sterylnych, wyjąć gotową do użycia strzykawkę z worka
wewnętrznego i umieścić bezpośrednio w sterylnej łaźni wodnej. Upewnić się, że zawartość gotowej
do użycia strzykawki jest całkowicie zanurzona w wodzie.
Tabela 1: Minimalny czas rozmrażania i ogrzewania w sterylnej łaźni wodnej
Minimalny czas rozmrażania/ogrzewania
Wielkość opakowania
33°C do 37°C, sterylna łaźnia wodna produkt wyjęty z worków
2 ml
5 minut
4 ml
5 minut
10 ml
12 minut
- 2) Rozmrażanie/ogrzewanie w niesterylnej łaźni wodnej
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych umieścić w łaźni wodnej poza obszarem
sterylnym na odpowiedni czas (patrz Tabela 2). Należy upewnić się, że worki pozostają zanurzone w
wodzie podczas całego czasu rozmrażania. Po rozmrożeniu wyjąć worki z łaźni wodnej, osuszyć
zewnętrzny worek i przenieść wewnętrzny worek z gotową do użycia strzykawką i tłokiem do obszaru
sterylnego.
Tabela 2: Minimalny czas rozmrażania i ogrzewania w niesterylnej łaźni wodnej
Minimalny czas rozmrażania/ogrzewania
Wielkość opakowania
33°C do 37°C, niesterylna łaźnia wodna produkt w workach
2 ml
30 minut
4 ml
40 minut
10 ml
80 minut
- 3) Rozmrażanie/ogrzewanie w inkubatorze
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych umieścić w inkubatorze poza obszarem
sterylnym na odpowiedni czas (patrz Tabela 3). Po rozmrożeniu/ogrzaniu wyjąć worki z inkubatora,
zdjąć zewnętrzny worek i przenieść wewnętrzny worek z gotową do użycia strzykawką do obszaru
sterylnego.
Tabela 3: Minimalny czas rozmrażania i ogrzewania w inkubatorze
Minimalny czas rozmrażania/ogrzewania
Wielkość opakowania
33°C do 37°C, inkubator produkt w workach
2 ml
40 minut
4 ml
85 minut
10 ml
105 minut
- 4) Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C) PRZED ogrzaniem
Instrukcja:
Gotową do użycia strzykawkę w obu workach ochronnych rozmrozić w temperaturze pokojowej poza
obszarem sterylnym przez odpowiedni czas (patrz Tabela 4). Po rozmrożeniu, w celu ogrzania
produktu do użycia, ogrzać go w worku zewnętrznym w inkubatorze. Po rozmrożeniu w temperaturze
pokojowej, maksymalny czas przechowywania produktu (w obu workach) w temperaturze pokojowej
wynosi 14 dni.
Tabela 4: Minimalny czas rozmrażania w temperaturze pokojowej poza obszarem sterylnym i czas
dodatkowego ogrzewania, w inkubatorze do temperatury od 33°C do 37°C
Minimalny czas rozmrażania produktu w temperaturze pokojowej (nieprzekraczającej 25°C) i czas ogrzewania w inkubatorze, przed użyciem, do temperatury od 33°C do
maksimum 37°C
Produkt w workach
Rozmrażanie w temperaturze pokojowej (nieprzekraczającej 25°C)
Wielkość opakowania
Ogrzewanie w inkubatorze (33°C-37°C)
2 ml
80 minut
+ 11 minut
4 ml
110 minut
+ 25 minut
10 ml
160 minut
+ 35 minut
Stabilność po rozmrożeniu
Po rozmrożeniu i ogrzaniu(w temperaturze od 33°C do 37°C, metody 1, 2 i 3), wykazano stabilność
chemiczną i fizyczną produktu przez 4 godziny w temperaturze od 33°C do 37°C.
Dla produktu rozmrożonegow temperaturze pokojowej, w nieotwartym worku (metoda 4), wykazano
stabilność chemiczną i fizyczną produktu przez 14 dni w temperaturze nieprzekraczającej 25°C.
Ogrzać do temperatury 33°C do 37°C bezpośrednio przed użyciem.
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast po ogrzaniu do temperatury
33°C do 37°C, chyba że metoda otwierania/rozmrażania wyklucza ryzyko zakażenia
mikrobiologicznego,
Jeśli produkt nie zostanie zużyty natychmiast, za czas i warunki przechowywania odpowiada
użytkownik.
Nie wolno ponownie zamrażać ani umieszczać w lodówce po rozpoczęciu rozmrażania.
Obchodzenie się z produktem po rozmrożeniu/przed podaniem
Aby uzyskać optymalne zmieszanie dwóch roztworów i optymalne zestalenie kleju fibrynowego,
należy utrzymywać temperaturę obu składników kleju na poziomie 33°C - 37°C do czasu
nałożenia.
Roztwór białek klejących i roztwór trombiny powinny być przezroczyste lub lekko opalizujące. Nie
wolno stosować roztworów mętnych lub zawierających osad. Rozmrożone produkty należy przed
zastosowaniem poddać ocenie wzrokowej pod kątem obecności nierozpuszczalnych cząstek oraz
zmiany barwy lub jakiejkolwiek zmiany w wyglądzie fizycznym. W przypadku wystąpienia jednej z
powyższych sytuacji, roztwór należy wyrzucić.
Rozmrożony roztwór białek klejących powinien być lekko lepkim płynem. Jeżeli roztwór ma postać
zestalonego żelu, należy przypuszczać, że uległ on denaturacji (prawdopodobnie na skutek przerwania
zimnego łańcucha przechowywania lub przegrzania podczas ogrzewania). W takim przypadku
NIE wolno pod żadnym warunkiem zastosować ARTISS.
- Nie wyjmować strzykawki z worka aż do momentu użycia.
- ARTISS stosować tylko po całkowitym rozmrożeniu i ogrzaniu (płynna konsystencja).
- Nasadkę ochronną usunąć ze strzykawki dopiero bezpośrednio przed nakładaniem.
Podawanie nienatryskowe przy użyciu strzykawki AST:
W celu nałożenia kleju, połączyć dwukomorową gotową do użycia strzykawkę wypełnioną roztworem
białek klejących i roztworem trombiny z łącznikiem i igłą aplikacyjną, dostarczonymi w załączonym
zestawie przyrządów. Wspólny tłok dwukomorowej gotowej do użycia strzykawki, dostarczony w
zestawie z urządzeniami aplikacyjnymi, zapewnia podawanie do łącznika jednakowych objętości obu
składników, które następnie zostają zmieszane w igle aplikacyjnej i następnie nałożone.
Instrukcja obsługi strzykawki AST:
- Usunąć całe powietrze ze strzykawki przed podłączeniem do urządzenia podajacego.
- Podłączyć łącznik i pasek do boku strzykawki z otworem na pasek zabezpieczający.
- Połączyć wyloty dwukomorowej gotowej do użycia strzykawki z łącznikiem, upewniając się, że są odpowiednio zamocowane. o Zabezpieczyć łącznik, mocując pasek zabezpieczający do gotowej do użycia dwukomorowej strzykawki. o W razie rozerwania paska zabezpieczającego wykorzystać łącznik dodatkowy zawarty w zestawie. o Jeśli nie ma już dodatkowego łącznika, zestaw może być w dalszym ciągu stosowany, jeśli zwróci się uwagę, żeby połączenie było trwałe i szczelne. o NIE usuwać powietrza pozostałego w łączniku.
- Zamocować igłę aplikacyjną do łącznika. o NIE usuwać powietrza z łącznika ani z igły aplikacyjnej przed rozpoczęciem właściwego nakładania kleju, gdyż w przeciwnym razie mogłoby to spowodować zatkanie igły.
Podawanie
Przed naniesieniem produktu ARTISS powierzchnię rany należy osuszyć, stosując standardowe
techniki (np. wymiana kompresów, gazików, stosowanie urządzeń odsysających). Do osuszania
powierzchni nie wolno stosować sprężonego powietrza lub gazu.
- Nałożyć zmieszany roztwór białka klejące - trombina na powierzchnię docelową lub powierzchnie, które mają być sklejone, wolno uciskając tylną część wspólnego tłoka.
- W zabiegach chirurgicznych, które wymagają stosowania minimalnych objętości kleju fibrynowego, zaleca się wyciśnięcie i usunięcie pierwszych kilku kropel produktu.
- Po nałożeniu ARTISS, odczekać co najmniej 3 minuty do osiągnięcia dostatecznej polimeryzacji.
Uwaga: Jeżeli nakładanie składników kleju fibrynowego zostanie przerwane, igła może ulec
natychmiastowemu zatkaniu. W takim przypadku igłę aplikacyjną należy wymienić na nową
dopiero bezpośrednio przed ponownym nałożeniem kleju. Jeśli niedrożne są ujścia łącznika,
należy wykorzystać dodatkowy łącznik znajdujący się w opakowaniu.
Aplikacja jest także możliwa przy użyciu innych przyrządów dostarczanych przez BAXTER,
które są specjalnie dostosowane do np. nakładania na duże lub trudno dostępne
powierzchnie. Stosując tego rodzaju przyrządy do aplikacji, należy dokładnie przestrzegać
ich Instrukcji używania.
W celu uzyskania dalszych instrukcji dotyczących przygotowania należy zwrócić się do
pielęgniarki lub lekarza.
Nanoszenie produktu za pomocą urządzenia rozpylającego
Regulator ciśnienia powinien być stosowany zgodnie z instrukcją producenta.
Podczas nanoszenia produktu ARTISS za pomocą urządzenia rozpylającego należy przestrzegać
ciśnienia oraz odległości od tkanki zgodnie z zaleceniami producenta, jak poniżej:
Zalecane wartości ciśnienia i odległości od tkanki oraz urządzenia rozpylające służące do nanoszenia produktu ARTISS
Zestaw
rozpylający, który
Końcówki
aplikatora, które
Regulator
ciśnienia, który
Zalecana
odległość
od tkanki
docelowej
Zalecane
ciśnienie
rozpylania
ma być
zastosowany
mają być
zastosowane
ma być
zastosowany
Zestaw
rozpylający
Tisseel/Artiss
nd.
EasySpray
Leczenie
chirurgiczne
rany otwartej
1,5–
2,0 barów
10–15 cm
Zestaw
rozpylający
Tisseel/Artiss —
opakowanie 10 szt.
(21,5–
28,5 psi)
tkanki
podskórnej
nd.
EasySpray
Podczas rozpylania produktu ARTISS należy monitorować zmiany ciśnienia tętniczego, tętna, nasycenia krwi tętniczej tlenem i końcowo-wydechowego stężenia COze względu na możliwość wystąpienia zatoru powietrznego lub gazowego (patrz Charakterystyka Produktu Leczniczego
punkty 4.2 i 4.4).
W przypadku stosowania końcówek pomocniczych z tym produktem, należy postępować zgodnie z
instrukcjami używania końcówek.
Usuwanie pozostałości
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
- Kraj rejestracji
- Wymaga receptyNie
- ImporterTakeda Manufacturing Austria AG
- Te treści mają charakter wyłącznie informacyjny i nie zastępują konsultacji lekarskiej.
Lekarze online w sprawie Artiss
Omów stosowanie Artiss, bezpieczeństwo i ocenę zasadności recepty zgodnie z obowiązującymi przepisami.
Często zadawane pytania

Bądź na bieżąco z Oladoctor
Informacje o nowych usługach, aktualizacjach produktu i przydatnych materiałach dla pacjentów.