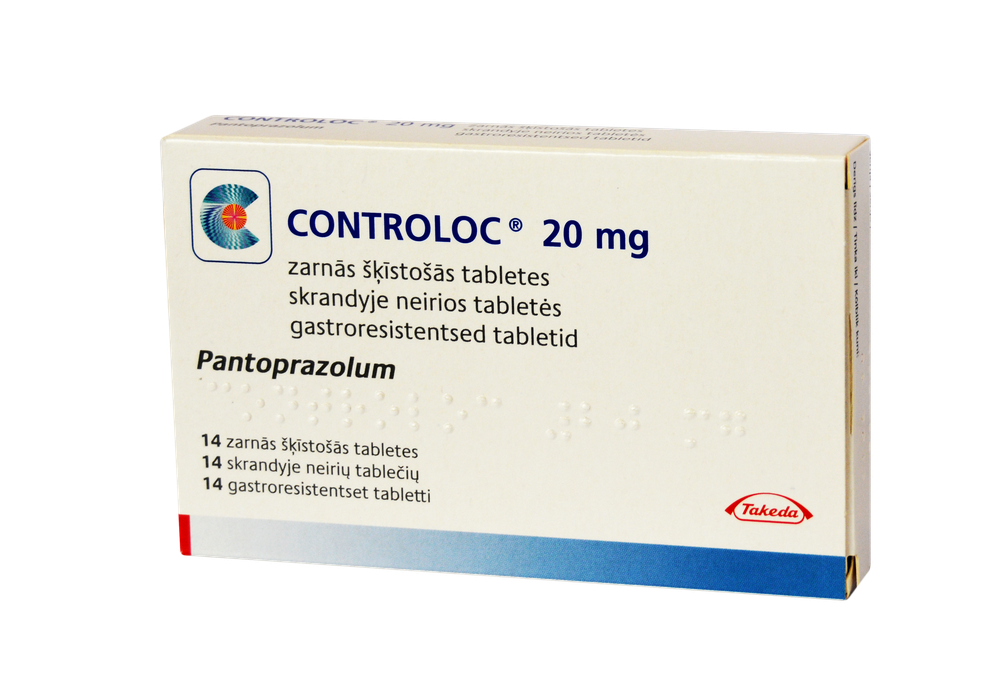
Цонтролоц 20

Інструкція із застосування Цонтролоц 20
Перекладено з використанням ШІ
Інформація на цій сторінці має довідковий характер і не замінює консультацію лікаря. Перед застосуванням будь-яких лікарських засобів проконсультуйтеся з медичним фахівцем.
Показати перекладЗміст інструкції
- CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- 1 Wskazania do stosowania
- 2 Dawkowanie i sposób podawania
- 3 Przeciwwskazania
- 4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
- 5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
- 6 Wpływ na płodność, ciążę i laktację
- 7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
- 8 Działania niepożądane
- 9 Przedawkowanie
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- 1 Właściwości farmakodynamiczne
- 2 Właściwości farmakokinetyczne
- 3 Przedkliniczne dane o bezpieczeństwie
- DANE FARMACEUTYCZNE
- 1 Wykaz substancji pomocniczych
- 2 Niezgodności farmaceutyczne
- 3 Okres ważności
- 4 Specjalne środki ostrożności podczas przechowywania
- 5 Rodzaj i zawartość opakowania
- 6 Specjalne środki ostrożności dotyczące usuwania
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
- NAZWA PRODUKTU LECZNICZEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
- WYKAZ SUBSTANCJI POMOCNICZYCH
- POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
- SPOSÓB I DROGA PODANIA
- OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
- INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
- TERMIN WAŻNOŚCI
- WARUNKI PRZECHOWYWANIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- NUMER SERII
- OGÓLNA KATEGORIA DOSTĘPNOŚCI
- INSTRUKCJA UŻYCIA
- INFORMACJA PODANA SYSTEMEM BRAILLE’A
- NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
- NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
- NAZWA PRODUKTU LECZNICZEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
- WYKAZ SUBSTANCJI POMOCNICZYCH
- POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
- SPOSÓB I DROGA PODANIA
- OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
- INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
- TERMIN WAŻNOŚCI
- WARUNKI PRZECHOWYWANIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- NUMER SERII
- OGÓLNA KATEGORIA DOSTĘPNOŚCI
- INSTRUKCJA UŻYCIA
- INFORMACJA PODANA SYSTEMEM BRAILLE’A
- NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
- NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
- NAZWA PRODUKTU LECZNICZEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
- WYKAZ SUBSTANCJI POMOCNICZYCH
- POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
- SPOSÓB I DROGA PODANIA
- OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
- INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
- TERMIN WAŻNOŚCI
- WARUNKI PRZECHOWYWANIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- NUMER SERII
- OGÓLNA KATEGORIA DOSTĘPNOŚCI
- INSTRUKCJA UŻYCIA
- INFORMACJA PODANA SYSTEMEM BRAILLE’A
- NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
- NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
- NAZWA PRODUKTU LECZNICZEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
- WYKAZ SUBSTANCJI POMOCNICZYCH
- POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
- SPOSÓB I DROGA PODANIA
- OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
- INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
- TERMIN WAŻNOŚCI
- WARUNKI PRZECHOWYWANIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- NUMER SERII
- OGÓLNA KATEGORIA DOSTĘPNOŚCI
- INSTRUKCJA UŻYCIA
- INFORMACJA PODANA SYSTEMEM BRAILLE’A
- NAZWA PRODUKTU LECZNICZEGO
- NAZWA PODMIOTU ODPOWIEDZIALNEGO
- TERMIN WAŻNOŚCI
- NUMER SERII
- INNE
- NAZWA PRODUKTU LECZNICZEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
- WYKAZ SUBSTANCJI POMOCNICZYCH
- POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
- SPOSÓB I DROGA(I) PODANIA
- OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
- INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
- TERMIN WAŻNOŚCI
- WARUNKI PRZECHOWYWANIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- NUMER SERII
- OGÓLNA KATEGORIA DOSTĘPNOŚCI
- INSTRUKCJA UŻYCIA
- INFORMACJA PODANA SYSTEMEM BRAILLE’A
- NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
- NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
- Co to jest lek Controloc 20 i w jakim celu się go stosuje
- Informacje ważne przed przyjęciem leku Controloc 20
- Jak przyjmować lek Controloc 20
- Możliwe działania niepożądane
- W przypadku wystąpienia któregokolwiek z poniższych działań niepożądanych, należy przerwać przyjmowanie tabletek i niezwłocznie poinformować lekarza lub skontaktować się z najbliższym szpitalem gdzie pełniony jest ostry dyżur:
- Działania niepożądane rozpoznawane za pomocą badań krwi występujące:
- Zgłaszanie działań niepożądanych
- Jak przechowywać lek Controloc 20
- Zawartość opakowania i inne informacje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
3. POSTAĆ FARMACEUTYCZNA
Tabletka dojelitowa (tabletka).
Żółta, owalna, obustronnie wypukła tabletka powlekana z brązowym nadrukiem „P20” z jednej strony.
4. SZCZEGÓŁOWE DANE KLINICZNE
4.1 Wskazania do stosowania
Controloc 20 wskazany jest do stosowania u dorosłych i młodzieży w wieku 12 lat i powyżej w:
- Objawowej postaci choroby refluksowej przełyku.
- Długotrwałym leczeniu i zapobieganiu nawrotom refluksowego zapalenia przełyku.
Controloc 20 wskazany jest do stosowania u dorosłych w:
- Zapobieganiu owrzodzeniom żołądka i dwunastnicy wywołanym stosowaniem nieselektywnych niesteroidowych leków przeciwzapalnych (NLPZ) u pacjentów z grupy zwiększonego ryzyka, wymagających długotrwałego stosowania NLPZ (patrz punkt 4.4).
4.2 Dawkowanie i sposób podawania
Dawkowanie
Dorośli i młodzież w wieku 12 lat i powyżej
Objawowa postać choroby refluksowej przełyku
Zalecana dawka doustna produktu Controloc 20 to 20 mg raz na dobę. Objawy ustępują zwykle po 2-4
tygodniach leczenia. Jeśli działanie nie jest wystarczające, lek należy stosować przez kolejne 4
tygodnie. Po ustąpieniu objawów, objawy nawracające można kontrolować stosując 1 tabletkę
Controloc 20 raz na dobę w razie potrzeby („na żądanie”). W przypadku niemożności opanowania
objawów przy dawkowaniu w razie potrzeby („na żądanie”) można rozważyć ponowne stosowanie
produktu w sposób ciągły.
Długotrwałe leczenie i zapobieganie nawrotom refluksowego zapalenia przełyku
W długotrwałym leczeniu zaleca się 1 tabletkę Controloc 20 raz na dobę jako dawkę podtrzymującą.
Jeśli wystąpi nawrót choroby, dawkę tę można zwiększyć do 40 mg pantoprazolu na dobę. W tym
przypadku zalecane jest stosowanie produktu Controloc 40. Po wyleczeniu nawrotu dawkę można
zmniejszyć ponownie do 1 tabletki produktu Controloc 20 na dobę.
Dorośli
Zapobieganie owrzodzeniom żołądka i dwunastnicy wywołanym stosowaniem nieselektywnych
niesteroidowych leków przeciwzapalnych (NLPZ) u pacjentów z grupy zwiększonego ryzyka,
wymagających długotrwałego stosowania NLPZ.
Zalecana dawka to 1 tabletka produktu Controloc 20 raz na dobę.
Szczególne grupy pacjentów
Pacjenci z zaburzeniami czynności wątroby
U pacjentów z ciężką niewydolnością wątroby nie należy stosować dawki dobowej większej niż
20 mg pantoprazolu (patrz punkt 4.4).
Pacjenci z zaburzeniami czynności nerek
U pacjentów z zaburzeniami czynności nerek nie ma konieczności modyfikacji dawkowania (patrz
punkt 5.2).
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku nie ma konieczności modyfikacji dawkowania (patrz punkt 5.2).
Dzieci i młodzież
Controloc 20 nie jest zalecany do stosowania u dzieci w wieku poniżej 12 lat, ze względu na
ograniczoną liczbę danych dotyczących bezpieczeństwa i skuteczności stosowania w tej grupie
wiekowej (patrz punkt 5.2).
Sposób podawania
Podanie doustne.
Tabletek nie należy żuć ani rozgryzać, należy je przyjmować 1 godzinę przed posiłkiem, połykając w
całości i popijając wodą.
4.3 Przeciwwskazania
Nadwrażliwość na substancję czynną, podstawione benzoimidazole lub na którąkolwiek substancję
pomocniczą wymienioną w punkcie 6.1.
4.4 Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Zaburzenia czynności wątroby
U pacjentów z ciężką niewydolnością wątroby, w okresie leczenia pantoprazolem, zwłaszcza
w przypadku długotrwałego stosowania produktu, należy regularnie kontrolować aktywność enzymów
wątrobowych. W przypadku zwiększenia aktywności enzymów wątrobowych należy przerwać
leczenie (patrz punkt 4.2).
Równoczesne podawanie z NLPZ
Stosowanie produktu Controloc 20 w zapobieganiu powstawania owrzodzeń żołądka i dwunastnicy
u pacjentów leczonych nieselektywnymi niesteroidowymi lekami przeciwzapalnymi (NLPZ) należy
ograniczyć do pacjentów, u których konieczne jest kontynuowanie leczenia NLPZ i występuje u nich
zwiększone ryzyko powstania zaburzeń żołądkowo-jelitowych. Zwiększone ryzyko wystąpienia
zaburzeń żołądkowo-jelitowych powinno być określone zgodnie z indywidualnymi czynnikami
ryzyka, m.in. podeszłym wiekiem (powyżej 65 lat), owrzodzeniem żołądka lub dwunastnicy,
krwawieniami z przewodu pokarmowego w wywiadzie.
Nowotwór żołądka
Objawowa odpowiedź na pantoprazol może maskować objawy nowotworu żołądka i może opóźniać
jego rozpoznanie. W przypadku wystąpienia objawów alarmowych (takich jak znaczna niezamierzona
utrata masy ciała, nawracające wymioty, dysfagia, krwawe wymioty, niedokrwistość, smołowate
stolce) oraz przy podejrzeniu lub stwierdzeniu owrzodzeń żołądka, należy wykluczyć ich podłoże
nowotworowe.
Należy rozważyć dalsze badania w przypadku pacjentów, u których objawy choroby utrzymują się
pomimo odpowiedniego leczenia.
Równoczesne podawanie z inhibitorami proteazy wirusa HIV
Nie zaleca się jednoczesnego podawania pantoprazolu z inhibitorami proteazy wirusa HIV, których
wchłanianie zależy od kwaśnego pH w żołądku, takimi jak atazanawir gdyż może to znacząco
zmniejszyć ich biodostępność (patrz punkt 4.5).
Wpływ na wchłanianie witaminy B
Pantoprazol, tak jak i inne leki hamujące wydzielanie kwasu solnego, może zmniejszać wchłanianie
witaminy B (cyjanokobalaminy). Jest to spowodowane niedoborem kwasu solnego w soku
żołądkowym lub bezkwaśnością soku żołądkowego. Należy to uwzględnić w trakcie długotrwałego
leczenia pacjentów z niedoborem witaminy B oraz obciążonych czynnikami ryzyka zaburzonego jej
wchłaniania lub jeśli wystąpią objawy kliniczne.
Długotrwała terapia
Przy długotrwałej terapii, szczególnie gdy leczenie trwa ponad rok, pacjenci powinni być objęci
regularnym nadzorem lekarza.
Zakażenia przewodu pokarmowego spowodowane przez bakterie
Leczenie produktem Controloc 20 może powodować niewielki wzrost ryzyka zakażeń przewodu
pokarmowego wywołanych bakteriami z rodziny Salmonellai Campylobacterlub Clostridium
difficile.
Hipomagnezemia
U pacjentów leczonych inhibitorami pompy protonowej (IPP), takimi jak pantoprazol, przez okres co
najmniej trzech miesięcy a w większości przypadków, przez okres jednego roku, rzadko stwierdzono
występowanie ciężkiej hipomagnezemii. Objawy ciężkiej hipomagnezemii, takie jak: zmęczenie,
tężyczka, majaczenie, drgawki, zawroty głowy i komorowe zaburzenia rytmu, mogą rozwinąć się w
sposób utajony i w związku z tym nie być rozpoznane. Hipomagnezemia może prowadzić do
hipokalcemii i (lub) hipokaliemii (patrz punkt 4.8). U pacjentów z największym nasileniem
hipomagnezemii (i hipomagnezemii związanej z hipokalcemią i (lub) hipokaliemią) zaprzestanie
stosowania inhibitorów pompy protonowej oraz rozpoczęcie leczenia suplementacyjnego magnezem
prowadziło do poprawy.
U pacjentów mających przyjmować inhibitory pompy protonowej przez dłuższy czas oraz u pacjentów
przyjmujących inhibitory pompy protonowej z lekami, takimi jak digoksyna lub innymi produktami
leczniczymi, które mogą powodować hipomagnezemię (np. diuretyki) pracownicy ochrony zdrowia
powinni rozważyć badanie stężenia magnezu przed rozpoczęciem terapii inhibitorami pompy
protonowej, jak i okresowo w jej trakcie.
Złamania kości
Stosowanie inhibitorów pompy protonowej, zwłaszcza przyjmowanych w dużych dawkach oraz w
długoterminowej terapii (powyżej 1 roku), może nieznacznie zwiększyć ryzyko złamań kości
biodrowej, kości nadgarstka lub kręgosłupa, szczególnie u osób w podeszłym wieku lub u osób z
innymi czynnikami ryzyka. Badania obserwacyjne sugerują, że inhibitory pompy protonowej mogą
zwiększać ogólne ryzyko złamań o 10-40%. Wzrost ryzyka może być spowodowany również innymi
czynnikami. Pacjenci z ryzykiem wystąpienia osteoporozy powinni być leczeni zgodnie z
obowiązującymi wytycznymi klinicznymi w celu zapewnienia przyjmowania odpowiedniej dawki
witaminy D i wapnia.
Ciężkie skórne reakcje niepożądane (ang. severe cutaneous adverse reactions, SCAR)
W związku z zastosowaniem pantoprazolu zgłaszano ciężkie skórne reakcje niepożądane z częstością
występowania „nieznana”, w tym rumień wielopostaciowy, zespół Stevensa-Johnsona (ang.
Stevens-Johnson syndrome, SJS), toksyczną rozpływną martwicę naskórka (ang. toxic epidermal
necrolysis, TEN) oraz reakcję polekową z eozynofilią i objawami ogólnoustrojowymi (ang. drug
reaction with eosinophilia and systemic symptoms, DRESS), które mogą zagrażać życiu lub
powodować zgon (patrz punkt 4.8).
Podczas przepisywania produktu leczniczego należy poinformować pacjentów o objawach
podmiotowych i przedmiotowych oraz ściśle monitorować ich pod kątem reakcji skórnych.
W przypadku pojawienia się objawów podmiotowych i przedmiotowych wskazujących na te reakcje
należy natychmiast odstawić pantoprazol i rozważyć alternatywne leczenie.
Podostra postać skórna tocznia rumieniowatego (SCLE)
Stosowanie inhibitorów pompy protonowej jest związane ze sporadycznym występowaniem SCLE.
Jeśli pojawią się zmiany skórne, zwłaszcza w miejscach narażonych na działanie promieni
słonecznych, z jednoczesnym bólem stawów, pacjent powinien niezwłocznie poszukać pomocy
medycznej, a lekarz powinien rozważyć możliwość przerwania stosowania produktu Controloc 20.
Wystąpienie SCLE w wyniku wcześniejszego leczenia inhibitorem pompy protonowej może
zwiększyć ryzyko SCLE w wyniku leczenia innymi inhibitorami pompy protonowej.
Wpływ na wyniki badań laboratoryjnych
Zwiększenie stężenia chromograniny A (CgA) może zakłócać badania wykrywające obecność guzów
neuroendokrynnych. Aby tego uniknąć, należy przerwać leczenie produktem leczniczym Controloc 20
na co najmniej 5 dni przed pomiarem stężenia CgA (patrz punkt 5.1). Jeżeli po pomiarze wstępnym
wartości stężenia CgA i gastryny nadal wykraczają poza zakres referencyjny, pomiary należy
powtórzyć po 14 dniach od zaprzestania leczenia inhibitorami pompy protonowej.
Controloc 20 zawiera sód.
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy lek uznaje się za
„wolny od sodu”.
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Produkty lecznicze których farmakokinetyka wchłaniania zależy od pH
Z powodu silnego i długotrwałego zahamowania wydzielania kwasu solnego w żołądku, pantoprazol
może zaburzać wchłanianie innych produktów leczniczych dla których pH w żołądku jest ważnym
czynnikiem wpływającym na biodostępność doustnej postaci leku np. niektóre azole
przeciwgrzybicze, takie jak ketokonazol, itrakonazol, pozakonazol i inne leki takie jak erlotynib.
Inhibitory proteazy wirusa HIV
Nie zaleca się jednoczesnego podawania pantoprazolu z inhibitorami proteazy wirusa HIV, których
wchłanianie zależy od kwaśnego pH w żołądku, takimi jak atazanawir gdyż może to znacząco
zmniejszyć ich biodostępność (patrz punkt 4.4).
Jeśli konieczne jest jednoczesne podanie inhibitorów proteazy wirusa HIV z inhibitorem pompy
protonowej zaleca się ścisłe monitorowanie stanu klinicznego pacjenta (np. miano wirusa). Nie należy
stosować dawki większej niż 20 mg pantoprazolu na dobę. Może być konieczne dostosowanie dawki
inhibitora proteazy wirusa HIV.
Przeciwzakrzepowe pochodne kumaryny (fenprokumon lub warfaryna)
Równoczesne podawanie pantoprazolu z warfaryną lub fenprokumonem nie miało wpływu na
farmakokinetykę warfaryny, fenprokumonu lub zmianę wartości INR (ang. international normalized
ratio - międzynarodowy współczynnik znormalizowany). Jednakże odnotowano zwiększenie wartości
INR oraz czasu protrombinowego u pacjentów przyjmujących jednocześnie inhibitory pompy
protonowej oraz warfarynę lub fenoprokumon. Wzrost wartości INR oraz czasu protrombinowego
może prowadzić do nieprawidłowego krwawienia, a nawet zgonu. U pacjentów leczonych
jednocześnie pantoprazolem i warfaryną lub fenprokumonem konieczne może być monitorowanie
wzrostu wskaźnika INR oraz czasu protrombinowego.
Metotreksat
U niektórych pacjentów zaobserwowano, że równoczesne stosowanie dużych dawek metotreksatu (np.
300 mg) z inhibitorami pompy protonowej prowadziło do zwiększenia stężenia metotreksatu. Dlatego
też u pacjentów przyjmujących duże dawki metotreksatu, np. w chorobie nowotworowej lub łuszczycy
należy rozważyć czasowe przerwanie stosowania pantoprazolu.
Inne badania dotyczące interakcji
Pantoprazol jest w dużym stopniu metabolizowany w wątrobie przy udziale układu enzymatycznego
cytochromu P-450. Głównym szlakiem metabolicznym jest demetylacja przez CYP2C19, zaś inne
szlaki metaboliczne obejmują utlenienie przez CYP3A4.
Badania interakcji z innymi produktami leczniczymi, które są metabolizowane przy udziale tego
samego układu enzymatycznego, jak karbamazepina, diazepam, glibenklamid, nifedypina, i doustne
środki antykoncepcyjne zawierające lewonorgestrel i etynyloestriadol nie wykazały klinicznie
istotnych interakcji.
Nie można wykluczyć interakcji pantoprazolu z innymi produktami leczniczymi lub związkami
metabolizowanymi przy udziale tego samego układu enzymatycznego.
Wyniki z zakresu badań dotyczących interakcji wskazują, że pantoprazol nie ma wpływu na
metabolizm substancji czynnych metabolizowanych przez CYP1A2 (np. kofeina, teofilina), CYP2C9
(np. piroksykam, diklofenak, naproksen), CYP2D6 (np. metoprolol), CYP2E1 (np. etanol) oraz nie
koliduje z zależnym od p-glikoproteiny wchłanianiem digoksyny.
Nie stwierdzono żadnych interakcji z jednocześnie stosowanymi środkami zobojętniającymi kwas
solny.
Przeprowadzono również badania interakcji, w których podawano pantoprazol jednocześnie
z odpowiednimi antybiotykami (klarytromycyną, metronidazolem, amoksycyliną). Nie stwierdzono
występowania klinicznie istotnych interakcji.
Produkty lecznicze, które hamują lub indukują CYP2C19
Inhibitory cytochromu CYP2C19 takie jak fluwoksamina mogą zwiększać ekspozycję
ogólnoustrojową na pantoprazol. Należy rozważyć zmniejszenie dawki u pacjentów leczonych
długotrwale dużymi dawkami pantoprazolu lub u pacjentów z zaburzeniami czynności wątroby.
Induktory enzymów cytochromu CYP2C19 i CYP3A4, takie jak ryfampicyna lub ziele dziurawca
zwyczajnego ( Hypericum perforatum) mogą zmniejszać w osoczu stężenie inhibitorów pompy
protonowej, metabolizowanych przez te układy enzymatyczne.
Wpływ na badania laboratoryjne
W niektórych badaniach przesiewowych moczu na obecność tetrahydrokannabinolu (THC)
stwierdzono wyniki fałszywie dodatnie u pacjentów otrzymujących pantoprazol. Należy rozważyć
zastosowanie alternatywnej metody badania w celu weryfikacji wyników dodatnich.
4.6 Wpływ na płodność, ciążę i laktację
Ciąża
Umiarkowana ilość danych u kobiet w ciąży (pomiędzy 300-1000 kobiet w ciąży) nie wskazuje, aby
pantoprazol powodował wady rozwojowe lub działał toksycznie na płód i noworodka.
W badaniach na zwierzętach stwierdzono szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Dla
bezpieczeństwa zaleca się unikanie stosowania produktu Controloc 20 w trakcie ciąży.
Karmienie piersią
W badaniach na zwierzętach stwierdzono przenikanie pantoprazolu do mleka. Brak jest
wystarczających danych dotyczących przenikania pantoprazolu do mleka ludzkiego, jednak istnieją
doniesienia o takim przenikaniu. Nie można wykluczyć ryzyka wystąpienia działań niepożądanych
u noworodka/niemowlęcia karmionego piersią. Dlatego też należy podjąć decyzję czy przerwać
karmienie piersią czy przerwać/wstrzymać się od stosowania produktu Controloc 20 biorąc pod uwagę
korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
Płodność
W badaniach na zwierzętach nie stwierdzono zaburzenia płodności po podaniu pantoprazolu (patrz
punkt 5.3).
4.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Pantoprazol nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
Mogą wystąpić działania niepożądane, takie jak zawroty głowy i zaburzenia widzenia (patrz
punkt 4.8). W takich przypadkach pacjenci nie powinni prowadzić pojazdów mechanicznych ani
obsługiwać urządzeń mechanicznych w ruchu.
4.8 Działania niepożądane
U około 5% pacjentów mogą wystąpić działania niepożądane (ang. ADRs - adverse drug reactions).
W poniższej tabeli działania niepożądane zostały uszeregowane zgodnie z następującą klasyfikacją
częstości:
Bardzo często (≥1/10); często (≥1/100 do <1>(≥1/10 000 do <1>podstawie dostępnych danych).
Dla wszystkich działań niepożądanych zgłoszonych po wprowadzeniu produktu do obrotu, nie jest
możliwe zastosowanie klasyfikacji częstości, dlatego ich częstość jest oznaczona jako „nieznana”.
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione
od najcięższych do najmniej ciężkich.
Tabela nr 1. Działania niepożądane związane ze stosowaniem pantoprazolu zgłoszone w badaniach
klinicznych i po wprowadzeniu do obrotu
| Częstość występowania Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana |
| Zaburzenia krwi i układu chłonnego | agranulocytoza | małopłytkowość, leukopenia, pancytopenia | |||
| Zaburzenia układu immunologiczne go | nadwrażliwość (w tym reakcje anafilaktyczne i wstrząs anafilaktyczny) | ||||
| Zaburzenia metabolizmu i odżywiania | hiperlipidemie i zwiększone stężenie lipidów (triglicerydy, cholesterol), zmiany masy ciała | hiponatremia, hipomagnezemia (patrz punkt 4.4), hipokalcemia(1), hipokaliemia(1) | |||
| Zaburzenia psychiczne | zaburzenia snu | depresja (i wszystkie agrawacje) | dezorientacja (i wszystkie agrawacje) | omamy, splątanie (szczególnie u pacjentów predyspono- wanych, jak również nasilenie tych objawów w przypadku ich wcześniejszego występowania) | |
| Zaburzenia układu nerwowego | ból głowy, zawroty głowy | zaburzenia smaku | parestezje | ||
| Zaburzenia oka | zaburzenia widzenia / niewyraźne widzenie | ||||
| Zaburzenia żołądka i jelit | polipy dna żołądka (łagodne) | biegunka, nudności i (lub) wymioty, uczucie pełności w jamie brzusznej i wzdęcia, zaparcia; suchość w jamie ustnej, ból i dyskomfort w nadbrzuszu | mikroskopowe zapalenie jelita grubego | ||
| Zaburzenia wątroby i dróg | zwiększona aktywność | zwiększenie stężenia | uszkodzenia komórek wątroby, |
| Częstość występowania Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana |
| żółciowych | enzymów wątrobowych (aminotransferaz, γ-GT) | bilirubiny | żółtaczka, niewydolność komórek wątroby | ||
| Zaburzenia skóry i tkanki podskórnej | wysypka skórna / wyprysk / wykwity skórne, świąd | pokrzywka, obrzęk naczynio- ruchowy | zespół Stevensa– Johnsona, zespół Lyella (TEN), wysypka polekowa z eozynofilią i objawami ogólnoustrojowymi (zespół DRESS), rumień wielopostaciowy, nadwrażliwość na światło, podostra postać skórna tocznia rumieniowatego (patrz punkt 4.4) | ||
| Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | złamania kości biodrowej, kości nadgarstka lub kręgosłupa (patrz punkt 4.4) | bóle stawów, bóle mięśni | skurcze mięśni(2) | ||
| Zaburzenia nerek i dróg moczowych | cewkowo- śródmiąższowe zapalenie nerek (ang. tubulointerstitial nephritis, TIN) (z możliwością pogorszenia czynności nerek do niewydolności nerek) | ||||
| Zaburzenia układu rozrodczego i piersi | ginekomastia | ||||
| Zaburzenia ogólne i stany w miejscu podania | osłabienie, zmęczenie i złe samopoczucie | podwyższenie temperatury ciała, obrzęki obwodowe |
Hipokalcemia i (lub) hipokaliemia mogą być związane z występowaniem hipomagnezemii
(patrz punkt 4.4)
Skurcze mięśni w wyniku zaburzeń elektrolitowych
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania
produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać
wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl .
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
4.9 Przedawkowanie
Nie są znane objawy przedawkowania u ludzi.
Dawki do 240 mg podawane dożylnie przez 2 minuty były dobrze tolerowane.
Ponieważ pantoprazol w znacznym stopniu wiąże się z białkami osocza, trudno poddaje się dializie.
W przypadku przedawkowania z klinicznymi objawami zatrucia, poza leczeniem objawowym
i wspomagającym, brak właściwych zaleceń terapeutycznych.
5. WŁAŚCIWOŚCI FARMAKOLOGICZNE
5.1 Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: Inhibitory pompy protonowej, kod ATC: A02BC02
Mechanizm działania
Pantoprazol jest podstawionym benzoimidazolem, który hamuje wydzielanie kwasu solnego w
żołądku poprzez specyficzne blokowanie pompy protonowej w komórkach okładzinowych.
W kwaśnym środowisku komórek okładzinowych, pantoprazol przekształcany jest do postaci czynnej
i hamuje aktywność H+, K+-ATP-azy, czyli końcowy etap wytwarzania kwasu solnego w żołądku.
Stopień zahamowania wydzielania kwasu solnego jest zależny od dawki i dotyczy zarówno
podstawowego, jak i stymulowanego wydzielania kwasu solnego. U większości pacjentów ustąpienie
objawów osiągane jest w ciągu 2 tygodni. Tak jak w przypadku innych inhibitorów pompy protonowej
oraz antagonistów receptorów histaminowych H , leczenie pantoprazolem prowadzi do zmniejszenia
kwaśności treści żołądkowej oraz wtórnego zwiększenia wydzielania gastryny w stopniu
proporcjonalnym do zmniejszenia kwaśności. Wydzielanie gastryny jest odwracalne. Ponieważ
pantoprazol wiąże się z pompą protonową na poziomie receptora komórkowego, może on wpływać na
wydzielanie kwasu solnego niezależnie od stymulacji przez inne substancje (acetylocholina,
histamina, gastryna). Skutek jest taki sam niezależnie od tego, czy produkt jest podawany doustnie czy
dożylnie.
Działanie farmakodynamiczne
Wartości stężenia gastryny na czczo ulegają zwiększeniu pod wpływem pantoprazolu. Podczas
krótkotrwałego stosowania w większości przypadków wartości te nie przekraczają górnej granicy
normy. Podczas długotrwałego leczenia stężenie gastryny w większości przypadków ulega
podwojeniu. Jednak nadmierne zwiększenie stężenia gastryny występuje tylko w sporadycznych
przypadkach. W wyniku tego, w rzadkich przypadkach długotrwałego leczenia obserwowano łagodne
do umiarkowanego zwiększenie liczby specyficznych komórek wydzielania wewnętrznego ECL (ang.
enterochromaffin-like cell) w żołądku (rozrost prosty do gruczolakowatego). Jednak zgodnie z
dotychczas przeprowadzonymi badaniami, powstawanie zmian przedrakowiakowych (rozrost
atypowy), czy rakowiaków żołądka, jakie stwierdzono w badaniach na zwierzętach (patrz punkt 5.3),
nie było obserwowane u ludzi.
W przypadku długotrwałej terapii, gdy leczenie pantoprazolem trwa ponad rok, zgodnie z wynikami
badań na zwierzętach, nie można całkowicie wykluczyć wpływu pantoprazolu na parametry
wewnątrzwydzielnicze tarczycy.
Podczas leczenia przeciwwydzielniczymi produktami leczniczymi stężenie gastryny w surowicy ulega
zwiększeniu w odpowiedzi na zmniejszenie wydzielania kwasu solnego. Stężenie CgA również
zwiększa się z powodu zmniejszenia kwasowości wewnątrzżołądkowej. Zwiększenie stężenia CgA
może zakłócać badania wykrywające obecność guzów neuroendokrynnych.
Dostępne opublikowane dowody wskazują, że leczenie inhibitorami pompy protonowej należy
przerwać w okresie od 5 do 2 tygodni przed pomiarem stężenia CgA. Ma to na celu umożliwienie
powrotu stężenia CgA, mylnie zwiększonego w wyniku leczenia inhibitorami pompy protonowej, do
zakresu referencyjnego.
5.2 Właściwości farmakokinetyczne
Wchłanianie
Pantoprazol wchłania się szybko z przewodu pokarmowego, osiągając maksymalne stężenie w osoczu
nawet po pojedynczej doustnej dawce 20 mg. Maksymalne stężenie w surowicy krwi występuje
przeciętnie 2,0-2,5 godziny po podaniu i wynosi około 1-1,5 µ g/ml. Wartości te nie ulegają zmianie po
wielokrotnym podaniu.
Nie ma różnic w farmakokinetyce po pojedynczym i wielokrotnym podaniu. W zakresie dawek 10
do 80 mg kinetyka osoczowa pantoprazolu ma przebieg liniowy zarówno po podaniu doustnym, jak
i dożylnym.
Całkowita dostępność biologiczna pantoprazolu w postaci tabletki wynosi około 77%. Jednoczesne
przyjmowanie pokarmu nie ma wpływu na wartość pola pod krzywą (ang. AUC), maksymalne
stężenie w surowicy, a tym samym na biodostępność. Równoczesne przyjmowanie pokarmu może
wpłynąć na opóźnienie działania leku.
Dystrybucja
Pantoprazol wiąże się z białkami krwi w około 98%. Objętość dystrybucji wynosi około 0,15 l/kg.
Metabolizm
Substancja jest metabolizowana prawie wyłącznie w wątrobie. Głównym szlakiem metabolicznym jest
demetylacja przez CYP2C19 z późniejszym sprzęganiem z siarczanem, zaś inne szlaki metaboliczne
obejmują utlenienie przez CYP3A4.
Eliminacja
Okres półtrwania końcowej fazy eliminacji wynosi około 1 godziny, a klirens około 0,1 l/h/kg.
Odnotowano kilka przypadków, w których stwierdzono opóźnienie wydalania. W związku z tym, że
pantoprazol specyficznie wiąże się z pompą protonową w komórkach okładzinowych, okres
półtrwania dla fazy eliminacji nie koreluje z dłuższym okresem działania (zahamowanie wydzielania
kwasu).
Metabolity pantoprazolu są wydalane przede wszystkim przez nerki (około 80%), reszta wydalana jest
z kałem. Głównym metabolitem zarówno w osoczu, jak i w moczu jest demetylopantoprazol, który
jest sprzęgany z siarczanem. Okres półtrwania głównego metabolitu (około 1,5 godziny) nie różni się
znacznie od okresu półtrwania pantoprazolu.
Szczególne grupy pacjentów
Pacjenci słabo metabolizujący
U około 3% populacji europejskiej, określonej jako słabo metabolizująca, nie występuje funkcjonalny
enzym CYP2C19. U tych osób metabolizm pantoprazolu jest prawdopodobnie katalizowany głównie
przez CYP3A4. Po podaniu pojedynczej dawki 40 mg pantoprazolu, średnie pole powierzchni pod
krzywą zależności stężenia w osoczu do czasu było 6 razy większe u osób słabo metabolizujących
w porównaniu do osób posiadających funkcjonalny enzym CYP2C19 (intensywnie metabolizujący).
Średnie wartości maksymalnego stężenia w osoczu wzrosły o około 60%. Dane te nie mają wpływu
na dawkowanie pantoprazolu.
Pacjenci z zaburzeniami czynności nerek
Nie ma konieczności zmniejszania dawki pantoprazolu u osób z zaburzeniami czynności nerek (w tym
u pacjentów poddawanych dializie). Tak jak u zdrowych osób, okres półtrwania pantoprazolu jest
krótki. Tylko niewielkie ilości pantoprazolu są usuwane podczas dializy. Chociaż okres półtrwania
głównego metabolitu jest umiarkowanie wydłużony (2-3 godziny), wydalanie jest nadal szybkie i nie
dochodzi do kumulacji produktu.
Pacjenci z zaburzeniami czynności wątroby
U pacjentów z marskością wątroby (klasa A i B według Childa) okres półtrwania wydłuża się do 3-6
godzin, a wartości AUC zwiększają się 3-5-krotnie. Mimo to, maksymalne stężenie w surowicy
zwiększa się tylko nieznacznie, 1,3-krotnie w porównaniu ze zdrowymi osobami.
Pacjenci w podeszłym wieku
Niewielkie zwiększenie wartości AUC oraz stężenia maksymalnego (ang. C ) u ochotników w
podeszłym wieku w porównaniu z ochotnikami w młodszym wieku także nie jest klinicznie istotne.
Dzieci i młodzież
Po podaniu dzieciom w wieku 5 – 16 lat pojedynczej doustnej dawki 20 lub 40 mg pantoprazolu
wartości AUC i C odpowiadały zakresowi wartości dla dorosłych.
Po pojedynczym podaniu dożylnym dzieciom w wieku 2 – 16 lat pantoprazolu w dawce 0,8 lub
1,6 mg/kg masy ciała, nie stwierdzono znaczącej zależności pomiędzy klirensem pantoprazolu
a wiekiem lub masą ciała. Wartość AUC oraz objętość dystrybucji były zgodne z danymi uzyskanymi
u osób dorosłych.
5.3 Przedkliniczne dane o bezpieczeństwie
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących
bezpieczeństwa, badań toksyczności po podaniu wielokrotnym oraz genotoksyczności, nie ujawniają
żadnego szczególnego zagrożenia dla człowieka.
W dwuletnich badaniach rakotwórczości przeprowadzonych na szczurach, stwierdzono występowanie
nowotworów neuroendokrynnych. Ponadto w jednym badaniu zaobserwowano u szczurów
występowanie brodawczaków komórek nabłonka płaskiego w przedżołądku. Mechanizm prowadzący
do powstania rakowiaków żołądka przez podstawione benzoimidazole został dokładnie zbadany
i pozwala stwierdzić, że jest to reakcja wtórna do znacznie zwiększonych stężeń gastryny w surowicy
krwi, występujących u szczurów podczas długotrwałego podawania pantoprazolu w dużych dawkach.
W dwuletnich badaniach nad gryzoniami zaobserwowano zwiększoną ilość przypadków guzów
wątroby u szczurów oraz samic myszy, co było tłumaczone zjawiskiem zależnym od dużej szybkości
metabolizmu pantoprazolu w wątrobie.
W przypadku szczurów otrzymujących największe dawki pantoprazolu (200 mg/kg mc.)
zaobserwowano niewielkie zwiększenie częstości występowania zmian nowotworowych w tarczycy.
Występowanie tych nowotworów jest związane ze zmianami rozkładu tyroksyny w wątrobie
szczurów, wywołanymi przez pantoprazol. Ponieważ dawki lecznicze u ludzi są małe, nie oczekuje się
żadnych działań niepożądanych ze strony gruczołu tarczowego.
W badaniu wpływu na reprodukcję u szczurów w okresie około-poporodowym, mającym na celu
ocenę rozwoju kości, obserwowano oznaki toksyczności u potomstwa (śmiertelność, niższa średnia
masa ciała, niższy średni przyrost masy ciała i zmniejszony wzrost kości) przy ekspozycji (C )
odpowiadającej około 2-krotności ekspozycji klinicznej u ludzi. Pod koniec fazy rekonwalescencji
parametry kostne były podobne we wszystkich grupach, a masy ciała również wykazywały tendencję
do odwracalności po upłynięciu okresu rekonwalescencji bez podawania leku. Zwiększoną
śmiertelność obserwowano jedynie w przypadku młodych szczurów przed zakończeniem karmienia
mlekiem matki (w wieku do 21 dni), które szacunkowo odpowiadają wiekiem niemowlętom w wieku
do 2 lat. Znaczenie tej obserwacji dla populacji dzieci i młodzieży nie jest znane. Wcześniejsze
badanie u szczurów w okresie okołoporodowym, z podawaniem nieznacznie mniejszych dawek, nie
wykazało żadnych działań niepożądanych po podaniu dawki 3 mg/kg mc. w porównaniu do niskiej
dawki 5 mg/kg mc. zastosowanej w tym badaniu.
Badania nie wykazały wpływu na osłabienie płodności ani działania teratogennego.
Badania u szczurów dotyczące przenikania produktu przez barierę łożyskową wykazały zwiększone
przenikanie produktu do krążenia płodowego w zaawansowanej ciąży. W wyniku tego stężenie
pantoprazolu u płodu jest zwiększone krótko przed porodem.
6. DANE FARMACEUTYCZNE
6.1 Wykaz substancji pomocniczych
Rdzeń
Sodu węglan bezwodny
Mannitol (E421)
Krospowidon
Powidon K90
Wapnia stearynian
Otoczka
Hypromeloza
Powidon K25
Tytanu dwutlenek (E171)
Żelaza tlenek żółty (E172)
Glikol propylenowy (E1520)
Kwasu metakrylowego i etylu akrylanu kopolimer (1:1)
Polisorbat 80
Sodu laurylosiarczan
Trietylu cytrynian
Tusz
Szelak
Żelaza tlenek czerwony (E172)
Żelaza tlenek czarny (E172)
Żelaza tlenek żółty (E172)
Amonowy wodorotlenek stężony
6.2 Niezgodności farmaceutyczne
Nie dotyczy.
6.3 Okres ważności
Opakowania zawierające blistry
3 lata
Butelki
Nie otwarte: 3 lata
Okres ważności produktu po pierwszym otwarciu: 120 dni.
6.4 Specjalne środki ostrożności podczas przechowywania
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
6.5 Rodzaj i zawartość opakowania
Butelka z HDPE zabezpieczona zakrętką LDPE.
7
tabletek dojelitowych
10
tabletek dojelitowych
14
tabletek dojelitowych
15
tabletek dojelitowych
24
tabletki dojelitowe
28
tabletek dojelitowych
30
tabletek dojelitowych
48
tabletek dojelitowych
49
tabletek dojelitowych
56
tabletek dojelitowych
60
tabletek dojelitowych
84
tabletki dojelitowe
90
tabletek dojelitowych
98
tabletek dojelitowych
98 (2x49) tabletek dojelitowych
100
tabletek dojelitowych
112
tabletek dojelitowych
Opakowania szpitalne
50
tabletek dojelitowych
56
tabletek dojelitowych
84
tabletki dojelitowe
90
tabletek dojelitowych
112
tabletek dojelitowych
140
tabletek dojelitowych
140 (10x14), (5x28) tabletek dojelitowych
150 (10x15) tabletek dojelitowych
280 (20x14), (10x28)
tabletek dojelitowych
500
tabletek dojelitowych
700 (5x140) tabletek dojelitowych
Blistry (Aluminium/Aluminium).
Blistry (Aluminium/Aluminium) z papierową osłoną (portfelik na blister).
7
tabletek dojelitowych
10
tabletek dojelitowych
14
tabletek dojelitowych
15
tabletek dojelitowych
24
tabletki dojelitowe
28
tabletek dojelitowych
30
tabletek dojelitowych
48
tabletek dojelitowych
49
tabletek dojelitowych
56
tabletek dojelitowych
60
tabletek dojelitowych
84
tabletki dojelitowe
90
tabletek dojelitowych
98
tabletek dojelitowych
98 (2x49) tabletek dojelitowych
100
tabletek dojelitowych
112
tabletek dojelitowych
168
tabletek dojelitowych
Opakowania szpitalne
50
tabletek dojelitowych
56
tabletek dojelitowych
84
tabletki dojelitowe
90
tabletek dojelitowych
112
tabletek dojelitowych
140
tabletek dojelitowych
50 (50x1) tabletek dojelitowych
140 (10x14), (5x28) tabletek dojelitowych
150 (10x15) tabletek dojelitowych
280 (20x14), (10x28)
tabletek dojelitowych
500
tabletek dojelitowych
700 (5x140) tabletek dojelitowych
W Polsce zarejestrowane są opakowania z 14, 28 i 60 tabletkami w blistrach Aluminium/Aluminium;
z 14, 28 tabletkami w blistrach Aluminium/Aluminium w papierowej osłonie oraz z 14, 28 i 100
tabletkami w butelce z HDPE z zakrętką z LDPE.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
6.6 Specjalne środki ostrożności dotyczące usuwania
Brak szczególnych wymagań.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć w sposób zgodny
z lokalnymi przepisami.
7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
DOPUSZCZENIE DO OBROTU
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
[email protected]
8. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
4787
9. DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29 lutego 2000 r.
Data ostatniego przedłużenia pozwolenia: 16 marca 2010 r.
10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
26 kwietnia 2023 r.
OZNAKOWANIE OPAKOWAŃ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Pudełko na blistry (1 x 14 tab)
Pudełko na blistry (2 x 14 tab)
Pudełko na blistry (4 x 15 tab)
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
3. WYKAZ SUBSTANCJI POMOCNICZYCH
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
14 tabletek dojelitowych kod 5909990478767
28 tabletek dojelitowych kod 5909990478774
60 tabletek dojelitowych kod 5909990820351
5. SPOSÓB I DROGA PODANIA
Podanie doustne.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Należy połykać w całości, nie żuć ani nie rozgryzać.
6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
8. TERMIN WAŻNOŚCI
Termin ważności (EXP):
9. WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI
WŁAŚCIWE
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
((logo podmiotu))
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr 4787
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rp - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
controloc 20
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Obejmuje kod 2D będący nośnikiem niepowtarzalnego identyfikatora.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
PC:
SN:
NN:
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Pudełko na blistry w papierowej osłonie (2 x 7 tab)
Pudełko na blistry w papierowej osłonie (4 x 7 tab)
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
3. WYKAZ SUBSTANCJI POMOCNICZYCH
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
14 tabletek dojelitowych kod 5909990614967
28 tabletek dojelitowych kod 5909990614974
5. SPOSÓB I DROGA PODANIA
Podanie doustne.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Należy połykać w całości, nie żuć ani nie rozgryzać.
6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
8. TERMIN WAŻNOŚCI
Termin ważności (EXP):
9. WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI
WŁAŚCIWE
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
((logo podmiotu))
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr 4787
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rp - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
controloc 20
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Nie dotyczy
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
Nie dotyczy
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Pudełko na butelkę (14 tab)
Pudełko na butelkę (28 tab)
Pudełko na butelkę (100 tab)
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
3. WYKAZ SUBSTANCJI POMOCNICZYCH
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
14 tabletek dojelitowych kod 5909990478729
28 tabletek dojelitowych kod 5909990478736
100 tabletek dojelitowych kod 5909990478743
5. SPOSÓB I DROGA PODANIA
Podanie doustne.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Należy połykać w całości, nie żuć ani nie rozgryzać.
6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
8. TERMIN WAŻNOŚCI
Termin ważności (EXP):
Nie stosować leku po upływie 120 dni od pierwszego otwarcia butelki.
9. WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI
WŁAŚCIWE
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
((logo podmiotu))
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr 4787
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rp - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
controloc 20
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Obejmuje kod 2D będący nośnikiem niepowtarzalnego identyfikatora.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
PC:
SN:
NN:
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
Portfelik na blister
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
3. WYKAZ SUBSTANCJI POMOCNICZYCH
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
7 tabletek dojelitowych
5. SPOSÓB I DROGA PODANIA
Podanie doustne.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Należy połykać w całości, nie żuć ani nie rozgryzać.
6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
8. TERMIN WAŻNOŚCI
EXP:
9. WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI
WŁAŚCIWE
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
((logo podmiotu))
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr 4787
13. NUMER SERII
Lot:
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rp - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
MINIMUM INFORMACJI ZAMIESZCZANYCH NA BLISTRACH LUB OPAKOWANIACH
FOLIOWYCH
Blister
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki
pantoprazolum
2. NAZWA PODMIOTU ODPOWIEDZIALNEGO
((logo podmiotu))
3. TERMIN WAŻNOŚCI
EXP:
4. NUMER SERII
Lot:
5. INNE
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
Etykieta na butelkę
1. NAZWA PRODUKTU LECZNICZEGO
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
2. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ
Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego
półtorawodnego).
3. WYKAZ SUBSTANCJI POMOCNICZYCH
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
14 tabletek dojelitowych
28 tabletek dojelitowych
100 tabletek dojelitowych
5. SPOSÓB I DROGA(I) PODANIA
Podanie doustne.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
Należy połykać w całości, nie żuć ani nie rozgryzać.
6. OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO
W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
Lek przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
8. TERMIN WAŻNOŚCI
EXP:
Nie stosować leku po upływie 120 dni od pierwszego otwarcia butelki.
9. WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO
PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI
WŁAŚCIWE
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
((logo podmiotu))
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr 4787
13. NUMER SERII
Lot:
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rp - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
Controloc 20, 20 mg, tabletki dojelitowe
pantoprazolum
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten został przepisany ściśle określonej osobie. Nie należy go przekazywać innym osobom. Lek może zaszkodzić innej osobie, nawet jeśli objawy choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Controloc 20 i w jakim celu się go stosuje
- 2. Informacje ważne przed przyjęciem leku Controloc 20
- 3. Jak przyjmować lek Controloc 20
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Controloc 20
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Controloc 20 i w jakim celu się go stosuje
Lek Controloc 20 zawiera substancję czynną pantoprazol. Controloc 20 jest selektywnym „inhibitorem
pompy protonowej”, lekiem, który zmniejsza wydzielanie kwasu w żołądku. Stosowany jest w
leczeniu chorób żołądka i jelit związanych z wydzielaniem kwasu solnego.
Controloc 20 stosuje się u dorosłych i młodzieży w wieku 12 lat i powyżej w:
- Leczeniu objawów (np. zgaga, cofanie się kwasu, ból przy przełykaniu) związanych z chorobą refluksową przełyku spowodowaną cofaniem się kwasu solnego z żołądka.
- Długotrwałym leczeniu refluksowego zapalenia przełyku (stan zapalny przełyku, któremu towarzyszy cofanie się kwasu solnego z żołądka) oraz zapobiegania jego nawrotom.
Controloc 20 stosuje się u dorosłych w:
- Zapobieganiu owrzodzeniom dwunastnicy i (lub) żołądka spowodowanym niesteroidowymi lekami przeciwzapalnymi (NLPZ, np. ibuprofen) u pacjentów z grupy ryzyka, którzy muszą stale przyjmować NLPZ.
2. Informacje ważne przed przyjęciem leku Controloc 20
Kiedy nie przyjmować leku Controloc 20
- Jeśli pacjent ma uczulenie na pantoprazol lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- Jeśli u pacjenta stwierdzono uczulenie na leki zawierające inne inhibitory pompy protonowej.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem przyjmowania leku Controloc 20 należy poinformować lekarza, farmaceutę lub
pielęgniarkę.
- Jeśli u pacjenta występują poważne zaburzenia czynności wątroby. Należy poinformować lekarza, jeśli kiedykolwiek w przeszłości występowały zaburzenia czynności wątroby. Lekarz może zlecić częstszą kontrolę aktywności enzymów wątrobowych, szczególnie gdy stosowane jest długotrwałe leczenie lekiem Controloc 20. W razie zwiększenia aktywności enzymów wątrobowych stosowanie leku należy przerwać.
- Jeśli pacjent musi stale stosować leki z grupy NLPZ i jednocześnie przyjmować Controloc 20, ze względu na podwyższone ryzyko powikłań ze strony żołądka lub jelit. Podwyższone ryzyko zostanie ocenione zgodnie z czynnikami ryzyka dla danego pacjenta, takimi jak wiek (65 lat lub więcej), wrzody żołądka lub dwunastnicy w wywiadzie lub krwawienie z żołądka lub jelit.
- Jeśli u pacjenta występuje niedobór witaminy B lub występują czynniki ryzyka wskazujące na możliwość zmniejszenia stężenia witaminy B , a pacjent leczony jest długotrwale pantoprazolem. Podobnie jak w przypadku wszystkich leków zmniejszających (hamujących) wydzielanie kwasu solnego w żołądku, pantoprazol może prowadzić do zmniejszonego wchłaniania witaminy B . Należy skontaktować się z lekarzem w przypadku zauważenia któregokolwiek z następujących objawów, które mogą wskazywać na małe stężenie witaminy B :
- wyjątkowo silne zmęczenie lub brak energii,
- uczucie drętwienia i mrowienia,
- ból lub zaczerwienienie języka, owrzodzenia jamy ustnej,
- osłabienie mięśni,
- zaburzenia widzenia,
- problemy z pamięcią, dezorientacja, depresja.
- Jeśli pacjent przyjmuje inhibitory proteazy HIV, takie jak atazanawir (stosowany w leczeniu zakażenia HIV) jednocześnie z pantoprazolem, powinien poprosić lekarza o szczegółową poradę.
- Stosowanie inhibitora pompy protonowej, takiego jak pantoprazol, zwłaszcza przez okres powyżej 1 roku, może nieznacznie zwiększyć ryzyko złamań kości biodrowej, kości nadgarstka lub kręgosłupa. Należy powiedzieć lekarzowi, jeśli pacjent ma osteoporozę (zmniejszona gęstość kości) lub jeśli lekarz poinformował pacjenta, że pacjent jest narażony na ryzyko wystąpienia osteoporozy (na przykład jeśli pacjent stosuje leki z grupy steroidów). Jeśli pacjent przyjmuje Controloc 20 przez okres dłuższy niż trzy miesiące, może dojść u niego do zmniejszenia stężenia magnezu we krwi, co w konsekwencji może powodować zmęczenie, tężyczkę, zaburzenia orientacji, drgawki, zawroty głowy i komorowe zaburzenia rytmu serca. Jeśli u pacjenta wystąpi którykolwiek z wymienionych objawów, należy poinformować o tym lekarza. Niskie stężenie magnezu we krwi może również spowodować zmniejszenie stężenia potasu i wapnia we krwi. Lekarz może zadecydować o konieczności okresowego badania stężenia magnezu we krwi pacjenta.
- Jeśli u pacjenta kiedykolwiek występowała reakcja skórna w wyniku stosowania leku podobnego do leku Controloc 20, który zmniejsza wydzielanie kwasu solnego w żołądku.
- Jeśli u pacjenta kiedykolwiek wystąpiła wysypka skórna, zwłaszcza w miejscach narażonych na działanie promieni słonecznych, należy jak najszybciej powiedzieć o tym lekarzowi, ponieważ konieczne może być przerwanie stosowania leku Controloc 20. Należy również powiedzieć o wszelkich innych występujących działaniach niepożądanych, np. takich, jak ból stawów.
- W związku ze stosowaniem pantoprazolu zgłaszano ciężkie skórne reakcje, w tym zespół Stevensa-Johnsona, toksyczną rozpływną martwicę naskórka (ang. toxic epidermal necrolysis, TEN), reakcję polekową z eozynofilią i objawami ogólnoustrojowymi (ang. drug reaction witheosinophilia and systemic symptoms, DRESS) i rumień wielopostaciowy. Należy przerwać przyjmowanie pantoprazolu i niezwłocznie zasięgnąć porady lekarskiej w przypadku
zauważenia jakichkolwiek objawów związanych z tymi ciężkimi reakcjami skórnymi opisanymi
w punkcie 4.
- O planowanym specyficznym badaniu krwi (stężenie chromograniny A).
Należy natychmiast poinformować lekarzaprzed rozpoczęciem lub w trakcie przyjmowania leku, w
przypadku pojawienia się następujących objawów, które mogą być oznaką innej, poważniejszej
choroby:
- niezamierzona utrata masy ciała;
- wymioty, w szczególności nawracające;
- krwawe wymioty, które mogą wyglądać jak ciemne fusy po kawie;
- krew w kale, czarny lub smolisty kał;
- problemy z przełykaniem lub ból w trakcie przełykania;
- bladość i osłabienie (niedokrwistość);
- ból w klatce piersiowej;
- ból brzucha;
- ciężkie i (lub) uporczywe biegunki, ponieważ stosowanie tego leku wiąże się z niewielkim zwiększeniem ryzyka wystąpienia biegunki zakaźnej.
Lekarz może zdecydować o konieczności wykonania badań w celu wykluczenia podłoża
nowotworowego choroby, gdyż leczenie pantoprazolem może złagodzić objawy choroby
nowotworowej i opóźnić jej rozpoznanie. Jeśli objawy utrzymują się mimo leczenia, należy rozważyć
wykonanie dalszych badań.
W przypadku przyjmowania Controloc 20 przez dłuższy okres (ponad 1 rok), pacjent prawdopodobnie
będzie znajdował się pod stałą opieką lekarza. W takim przypadku należy w trakcie każdej wizyty
u lekarza zgłaszać wszelkie nowe i nieoczekiwane objawy oraz okoliczności ich wystąpienia.
Dzieci i młodzież
Controloc 20 nie jest zalecany do stosowania u dzieci, gdyż nie zbadano jego działania u dzieci
w wieku poniżej 12 lat.
Lek Controloc 20 a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta
obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, w tym o lekach, które
wydawane są bez recepty.
Ponieważ lek Controloc 20 może wpływać na skuteczność działania innych leków, należy
poinformować lekarza jeśli pacjent przyjmuje:
- Leki, takie jak ketokonazol, itrakonazol i pozakonazol (stosowane w leczeniu zakażeń grzybiczych) lub erlotynib (stosowany w pewnych typach nowotworów), ponieważ Controloc 20 może hamować prawidłowe działanie tych i innych leków.
- Warfarynę i fenprokumon, które wpływają na gęstość krwi i zapobiegają zakrzepom. Może istnieć konieczność wykonania dalszych badań.
- Leki stosowane w leczeniu zakażenia wirusem HIV, takie jak atazanawir.
- Metotreksat (stosowany w leczeniu reumatoidalnego zapalenia stawów, łuszczycy i chorób nowotworowych) w przypadku stosowania metotreksatu lekarz może czasowo przerwać stosowanie leku Controloc 20, ponieważ pantoprazol może zwiększać stężenie metotreksatu we krwi.
- Fluwoksaminę (stosowaną w leczeniu depresji i innych zaburzeń psychicznych) - jeśli pacjent przyjmuje fluwoksaminę, lekarz może zlecić zmniejszenie dawki.
- Ryfampicynę (stosowaną w leczeniu zakażeń).
- Ziele dziurawca zwyczajnego ( Hypericum perforatum) (stosowane w leczeniu łagodnej depresji).
Przed rozpoczęciem przyjmowania pantoprazolu należy omówić to z lekarzem, jeśli u pacjenta ma być
przeprowadzone specyficzne badanie moczu [na obecność tetrahydrokannabinolu (THC)].
Ciąża i karmienie piersią i wpływ na płodność
Doświadczenie w stosowaniu u kobiet w ciąży jest ograniczone. Stwierdzono przenikanie substancji
czynnej leku do mleka ludzkiego.
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Lek może być stosowany u kobiet w ciąży lub kobiet, u których nie można wykluczyć ciąży lub kobiet
karmiących piersią jedynie wtedy, jeśli lekarz uzna, że korzyść z jego stosowania jest większa, niż
potencjalne ryzyko dla nienarodzonego dziecka lub niemowlęcia.
Prowadzenie pojazdów i obsługiwanie maszyn
Controloc 20 nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
Nie należy prowadzić pojazdów mechanicznych ani obsługiwać urządzeń mechanicznych, jeżeli u
pacjenta wystąpią działania niepożądane, takie jak zawroty głowy lub zaburzenia widzenia.
Lek Controloc 20 zawiera sód
Ten lek zawiera mniej niż 1 mmol (23 mg) sodu w tabletce, to znaczy, że lek uznaje
się za „wolny od sodu”.
3. Jak przyjmować lek Controloc 20
Ten lek należy zawsze przyjmować zgodnie z zaleceniami lekarza lub farmaceuty. W razie
wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Sposób podawania
Lek przyjmować 1 godzinę przed posiłkiem, nie rozgryzając ani nie dzieląc tabletki. Połykać w całości
popijając wodą.
Zalecana dawka
Dorośli i młodzież w wieku 12 lat i powyżej:
- -W leczeniu objawów (np. zgaga, cofanie się kwasu, ból przy przełykaniu) związanych z chorobąrefluksową przełykuZazwyczaj stosowana dawka to jedna tabletka na dobę. Dawka ta zazwyczaj przynosi ulgę po 2-4 tygodniach stosowania – najpóźniej w ciągu kolejnych 4 tygodni. Lekarz zdecyduje, jak długo należy przyjmować lek. Nawracające objawy można kontrolować przyjmując jedną tabletkę na dobę, gdy jest to konieczne.
- -W długotrwałym leczeniu i zapobieganiu nawrotowi refluksowego zapalenia przełykuZazwyczaj stosowana dawka to jedna tabletka na dobę. Jeśli objawy choroby powrócą, lekarz może zalecić podwojenie dawki. W tym przypadku można zastosować jedną tabletkę na dobę leku Controloc 40. Po ustąpieniu objawów można ponownie zmniejszyć dawkę do jednej tabletki (20 mg) na dobę.
Dorośli:
- -W zapobieganiu wrzodom dwunastnicy i (lub) żołądka u pacjentów, którzy muszą stale przyjmowaćNLPZZazwyczaj stosowana dawka to jedna tabletka na dobę.
Pacjenci z zaburzeniami czynności wątroby
W przypadku ciężkich chorób wątroby nie należy przyjmować więcej niż jedną 20 mg tabletkę na
dobę.
Stosowanie u dzieci i młodzieży
Tabletki nie są zalecane do stosowania u dzieci w wieku poniżej 12 lat.
Przyjęcie większej niż zalecana dawki leku Controloc 20
Należy poradzić się lekarza lub farmaceuty. Objawy przedawkowania nie są znane.
Pominięcie przyjęcia leku Controloc 20
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki. Należy przyjąć
następną, zaplanowaną dawkę o zwykłej porze.
Przerwanie przyjmowania leku Controloc 20
Nie należy przerywać stosowania tabletek bez uprzedniej konsultacji z lekarzem lub farmaceutą.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub farmaceuty.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
W przypadku wystąpienia któregokolwiek z poniższych działań niepożądanych, należy przerwać przyjmowanie tabletek i niezwłocznie poinformować lekarza lub skontaktować się z najbliższym szpitalem gdzie pełniony jest ostry dyżur:
- Ciężkie reakcje uczuleniowe (rzadko: nie częściej niż u 1 na 1000 osób):obrzęk języka i (lub) gardła, trudności z przełykaniem, pokrzywka (wysypka jak po oparzeniu pokrzywą), trudności z oddychaniem, alergiczny obrzęk twarzy (obrzęk Quinckego / obrzęk naczynioruchowy), ciężkie zawroty głowy z przyspieszonym biciem serca i obfitym poceniem się.
- Ciężkie reakcje skórne (częstość nieznana:częstość nie może być określona na podstawiedostępnych danych):pacjent może zauważyć jeden lub kilka z poniższych objawów
- tworzenie się pęcherzy skórnych i gwałtowne pogorszenie stanu ogólnego, nadżerka (z lekkim krwawieniem) oczu, nosa, jamy ustnej/ust albo narządów płciowych lub wysypkę, szczególnie na obszarach skóry narażonych na działanie słońca. Może również wystąpić ból stawów lub objawy grypopodobne, gorączka, obrzęk gruczołów (np. pod pachami), a wyniki badań krwi mogą wykazywać zmiany w zakresie niektórych białych krwinek lub enzymów wątrobowych.
- czerwonawe, nieuniesione punkty lub okrągłe plamy na tułowiu, często z pęcherzami pośrodku, łuszczeniem skóry, owrzodzenie jamy ustnej, gardła, nosa, narządów płciowych i oczu. Pojawienie się takiej ciężkiej wysypki skórnej może poprzedzać gorączka i objawy grypopodobne (zespół Stevensa-Johnsona, toksyczna rozpływna martwica naskórka).
- rozległa wysypka, wysoka temperatura ciała i powiększone węzły chłonne (zespół DRESS lub zespół nadwrażliwości na lek).
- Inne ciężkie reakcje (częstość nieznana: częstość nie może być określona na podstawiedostępnych danych):żółte zabarwienie skóry i oczu (ciężkie uszkodzenie komórek wątroby, żółtaczka) lub gorączka, wysypka oraz problemy z nerkami przejawiające się ich powiększeniem, czasami z bólem podczas oddawania moczu i bólem w dolnej części pleców (ciężkie zapalenie nerek), mogące prowadzić do niewydolności nerek.
Inne działania niepożądane występujące:
- Często(nie częściej niż u 1 na 10 osób) Łagodne polipy żołądka.
- Niezbyt często(nie częściej niż u 1 na 100 osób) Ból głowy; zawroty głowy; biegunka; nudności, wymioty; uczucie pełności w jamie brzusznej i wzdęcia z oddawaniem wiatrów (wiatry); zaparcia; suchość w jamie ustnej; ból i dyskomfort
w obrębie brzucha; wysypka skórna, rumień, wykwity skórne; swędzenie skóry; osłabienie,
wyczerpanie lub ogólne złe samopoczucie; zaburzenia snu, złamania kości biodrowej, kości
nadgarstka lub kręgosłupa.
- Rzadko(nie częściej niż u 1 na 1000 osób) Zaburzenia lub całkowity brak odczuwania smaku; zaburzenia wzroku, takie jak niewyraźne widzenie; pokrzywka; bóle stawów; bóle mięśni; zmiany masy ciała; podwyższona temperatura ciała; wysoka gorączka; obrzęk kończyn (obrzęk obwodowy); reakcje alergiczne; depresja; powiększenie piersi u mężczyzn.
- Bardzo rzadko(nie częściej niż u 1 na 10 000 osób) Zaburzenia orientacji.
- Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych) Omamy, stan splątania (szczególnie u pacjentów, u których takie objawy wystąpiły już wcześniej); uczucie mrowienia, kłucia, mrowienia, pieczenie lub drętwienie, wysypka mogąca przebiegać z bólem stawów, zapalenie jelita grubego powodujące uporczywą wodnistą biegunkę.
Działania niepożądane rozpoznawane za pomocą badań krwi występujące:
- Niezbyt często(nie częściej niż u 1 na 100 osób) Zwiększona aktywność enzymów wątrobowych.
- Rzadko(nie częściej niż u 1 na 1000 osób) Zwiększone stężenie bilirubiny; zwiększone stężenie tłuszczów we krwi; związane z wysoką gorączką, nagłe zmniejszenie ilości krążących granulocytów - białych krwinek.
- Bardzo rzadko(nie częściej niż u 1 na 10 000 osób) Zmniejszenie liczby płytek krwi, co może powodować częstsze krwawienia i siniaki; zmniejszenie liczby białych krwinek, co może sprzyjać częstszym zakażeniom; współistniejące, nieprawidłowe zmniejszenie liczby czerwonych i białych krwinek, jak również płytek krwi.
- Częstość nieznana(częstość nie może być określona na podstawie dostępnych danych) Zmniejszenie stężenia sodu, magnezu, wapnia lub potasu we krwi (patrz punkt 2).
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie, lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych Al. Jerozolimskie 181 C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49
21 309, strona internetowa: https://smz.ezdrowie.gov.pl . Działania niepożądane można zgłaszać
również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie
zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Controloc 20
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku i blistrze lub butelce
podanego po oznaczeniu EXP. Termin ważności oznacza ostatni dzień danego miesiąca.
Butelka: nie stosować leku po upływie 120 dni od pierwszego otwarcia butelki.
Brak specjalnych zaleceń dotyczących przechowywania leku.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Controloc 20
- Substancją czynną leku jest pantoprazol. Każda tabletka dojelitowa zawiera 20 mg pantoprazolu (w postaci pantoprazolu sodowego półtorawodnego).
- Pozostałe składniki to: Rdzeń: sodu węglan bezwodny, mannitol (E421), krospowidon, powidon K90, wapnia stearynian. Otoczka: hypromeloza, powidon K25, tytanu dwutlenek (E171), żelaza tlenek żółty (E172), glikol propylenowy (E1520), kwasu metakrylowego i etylu akrylanu kopolimer (1:1), polisorbat 80, sodu laurylosiarczan, trietylu cytrynian. Tusz: szelak, żelaza tlenek czerwony, czarny i żółty (E172), amonowy wodorotlenek stężony.
Jak wygląda Controloc 20 i co zawiera opakowanie
Lek Controloc 20 to żółte, owalne, obustronnie wypukłe tabletki dojelitowe z napisem „P20” z jednej
strony.
Opakowania: butelki z HDPE z zakrętką LDPE lub blistry z folii Aluminium/Aluminium lub blistry z
folii Aluminium/Aluminium w papierowej osłonie (portfelik na blister).
Controloc 20 dostępny jest w następujących opakowaniach zawierających:
14, 28, 60 i 100 tabletek dojelitowych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
[email protected]
Wytwórca
Takeda GmbH
Miejsce wytwarzania Oranienburg
Lehnitzstrasse 70-98
16515 Oranienburg
Niemcy
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
| Nazwa państwa członkowskiego | Nazwa produktu leczniczego |
| Austria | Pantoloc 20 mg-Filmtabletten |
| Belgia | Pantozol |
| Bułgaria, Cypr | Controloc |
| Republika Czeska, Estonia, Grecja, Litwa, Łotwa, Rumunia, Słowacja, Słowenia, Węgry | Controloc 20 mg |
| Dania, Szwecja | Pantoloc |
| Finlandia, Norwegia | Somac |
| Francja | Eupantol 20 mg |
| Hiszpania | Pantecta 20 mg comprimidos gastrorresistentes, Ulcotenal 20 mg comprimidos gastrorresistentes |
| Holandia | Pantozol 20 mg |
| Irlandia | Protium 20 mg gastro-resistant tablets |
| Luksemburg | Pantozol-20 |
| Niemcy | Pantozol 20 mg, Pantoprazol 20 mg Byk, Rifun 20 mg |
| Portugalia | Pantoc, Apton, Pantoprazol ALTAN 20 mg |
| Polska | Controloc 20 |
| Włochy | Pantorc, Pantecta, Peptazol |
Data ostatniej aktualizacji ulotki 04/2023
- Країна реєстрації
- Діюча речовина
- Потрібен рецептТак
- Виробник
- ІмпортерNycomed GmbH
- Ця інформація надана лише для ознайомлення і не є медичною порадою. Рішення щодо лікування завжди приймає лікар.
- Альтернативи до Цонтролоц 20Лікарська форма: Таблетки, 40 мгДіюча речовина: pantoprazoleВиробник: Adamed Pharma S.A.Потрібен рецептЛікарська форма: Таблетки, 20 мгДіюча речовина: pantoprazoleВиробник: Adamed Pharma S.A. S.C. Terapia S.A.Рецепт не потрібенЛікарська форма: Таблетки, 20 мгДіюча речовина: pantoprazoleВиробник: Adamed Pharma S.A.Потрібен рецепт
Аналоги Цонтролоц 20 в інших країнах
Препарати з тією самою діючою речовиною, доступні в інших країнах.
Аналог Цонтролоц 20 у Україна
Лікарі онлайн щодо Цонтролоц 20
Застосування, безпека та можливість призначення рецепта — за результатами медичної оцінки.
Часті запитання

Будьте в курсі новин Oladoctor
Інформація про нові послуги, оновлення сервісу та корисні матеріали для пацієнтів.